Gastblog door Professor Chris Ponting en collega’s, ME/CFS Research Review van Simon McGrath, 28 augustus 2018
 Samenvatting
Samenvatting
Een nieuwe analyse die data gebruikt uit de UK Biobank toont aan dat één versie van een specifiek gen het risico op ME/CVS bij vrouwen verhoogt. Het gen codeert voor een transporteiwit in het mitochondriale membraan en speelt een zeer belangrijke rol in de ureumcyclus, die belangrijk is voor het verwijderen van ammoniak uit het lichaam. Verlaagde waarden van het transporteiwit, die te verwachten zijn voor de genvariant geassocieerd met ME/CVS, verstoren wellicht de mitochondriale functie. Als deze bevinding later wordt gerepliceerd, zou ze het eerste bewijs leveren dat het risico op ME/CVS veroorzaakt wordt door veranderingen in mitochondriale functie.
Achtergrond
Op 11 juni 2018 postten we een blog over een analyse van de data uit de UK Biobank, afkomstig van een half miljoen personen uit heel het VK. De data duidden erop dat er een genetische factor meespeelt in het risico dat iemand heeft op ME/CVS, maar het verschafte geen sterk bewijs dat verandering in eender welk deel van het DNA dit risico verklaarde.
Deze analyse noemt men een genoomwijde associatiestudie, of kortweg GWAS. Als er een verband is tussen een biologische factor (zoals veranderingen in cytokines) en een ziekte, dan is het normaal gezien mogelijk om te zeggen of de factor een oorzaak is van de ziekte, of simpelweg een gevolg van het ziek zijn. Maar omdat de genetische variatie eerst komt, moet het bijdragen aan een oorzaak, eerder dan dat het een effect van de ziekte zou zijn.

Een GWAS vraagt of de frequentie van een DNA-letterverschil voorspelt of iemand al dan niet een ziekte heeft;
Deze voorspelling is niet feilloos en weerspiegelt bijna altijd slechts een lichte voorkeur voor mensen met dit DNA-verschil voor een deel van de ziektecohort;
Belangrijk om weten is dat GWAS-voorspellingen duiden op een genetische oorzaak. Want overgeërfde ziekte (behalve kanker) veroorzaakt geen voorspelbare DNA-mutatie.
We schrijven nu opnieuw een blog omdat een nieuwe analyse een veelbelovende bevinding heeft onthuld.
Deze nieuwe analyse komt opnieuw uit de UK Biobankdata en werd gepost door Ben Neales lab. Nadat ze data hadden verwijderd die ze beschouwden als minder kwalitatief, bleven er data over van 194.174 vrouwen en 167.020 mannen. Ze waren zo vriendelijk om hun resultaten vrij beschikbaar te maken voor iedereen.
GWAS enkel van vrouwen
Als ze mannen en vrouwen samen namen, zagen ze geen specifieke regio van het menselijke genoom waar de DNA-varianten significant verband hielden met zelfgerapporteerde CVS/ME. (Eén variant, rs148723539, zou mogelijk aangewezen zijn [p = 2.3×10-9], maar dit wordt niet ondersteund door aangrenzende varianten.)
Maar de analyse van enkel vrouwen onthulde één enkele regio, op chromosoom 13. Tien DNA-varianten (enkel-nucleotide varianten/single nucleotide variants of SNVs) hadden een significant verband [SNVs met lage allelfrequentie <0.001 of met “lage betrouwbaarheid”, werden eruit gefilterd], bij gebruik van een waarschijnlijkheidsdrempel van p < 5×10-8.
Deze 10 SNVs worden samen overgeërfd doorheen de generaties (ze zitten in een “onevenwichtige koppeling” of “linkage disequilibrium”[LD]) en dus lijkt het erop dat dit slechts één verband is, eerder dan op tien verschillende. De 10 SNVs liggen allemaal in een basisregio 51.000 die het gen SLC25A15 omringt (Figuur 1 hieronder).
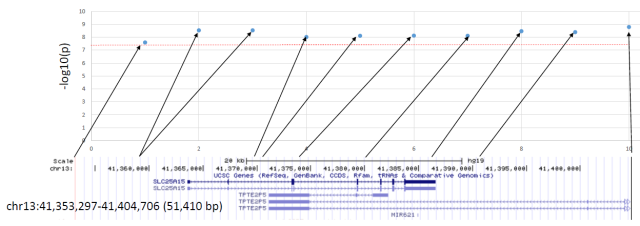
Figuur 1
Hun conclusie is dat DNA-variaties in dit deel van het genoom het risico van een vrouw om ME/CVS te krijgen, licht verhoogt. Dit moet betekenen dat deze verandering in het risico veroorzaakt wordt door één of meer DNA-verschillen in dit deel van het genoom. Maar omdat alle 10 verschillen samen worden overgeërfd, is het niet duidelijk welke diegene zijn die het verhoogde risico veroorzaken. Om de veroorzakende DNA-veranderingen precies vast te stellen, is er gedetailleerd experimenteel onderzoek nodig.
We kunnen zeggen dat een DNA-letter een verhoogd risico voorstelt (dit is de “risicoallel”). Zo is de 41.353.297e DNA-letter op chromosoom 13 bijvoorbeeld ofwel G ofwel A (de plaats krijgt de code rs7337312). Je hebt twee kopieën van chromosoom 13, dus ook twee versies van deze DNA-letter: je kan tweemaal G hebben (“GG“), tweemaal A (” AA“) of G en A (“GA“). Mensen van over heel de wereld hebben verschillende frequenties van G en A, maar uit de populatie van de UK Biobank blijkt dat de frequentie G ongeveer dezelfde is als die van A (~50%).
De resultaten van het lab van Ben Neale doen vermoeden dat een DNA-letter G hebben op deze positie op chromosoom 13 een licht verhoogd risico voorspelt op een ME/CVS-diagnose; twee zulke lettersG hebben, geeft een hoger risico dan slechts één G hebben. De frequentie van G van ~50% betekent dat ruwweg drie vierde van deze UK Biobankvrouwen ten minste één risico-G hebben.
Nog een resultaat van Neale was, dat vrouwen die G op deze positie hebben, vaker een licht verlaagd aantal lymfocyten hebben (rs7337312; p = 4.6×10-7; andere varianten in LD hebben p < 5×10-8). Lymfocyten zijn witte bloedcellen, vooral B-cellen en T-cellen. Ze laten ook zien dat G op deze positie twee biomechanische eigenschappen van het hoornvlies significant en licht verhogen (corneale hysterese en corneale weerstandsfactor).
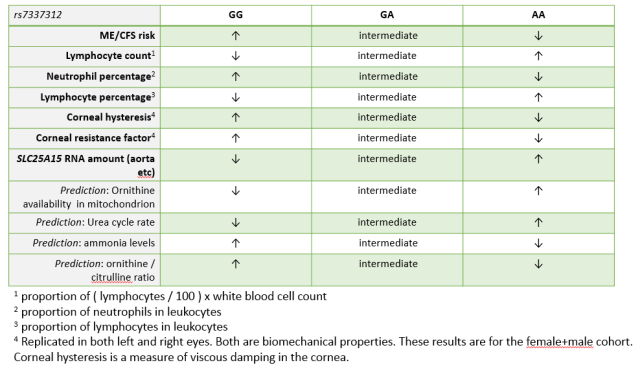
Figuur 2. Genetische effecten op het risico op ME/CVS en het aantal bloedcellen, en bijkomende voorspellingen
Ornithine Transporter type 1
Figuur 1 toont aan dat de genetische verbanden uit de GWAS gaan over DNA-verschillen die in of rond een bepaald gen liggen dat SLC25A15 heet. Er is een ander gen in dit Figuur dat een pseudogen is ( TPTE2P5), dat geen eiwit aanmaakt en minder geneigd is om de fysiologische functie te wijzigen bij mutatie. Dit wil niet noodzakelijk zeggen dat SLC25A15 rechtstreeks betrokken is als het gen waardoor dit genetische effect aangericht wordt.
Andere data wijzen er echter op dat mensen die G op deze positie hebben, vaak licht lagere hoeveelheden van SLC25A15-RNA produceren (in de aorta, de darm, de hippocampus, getransformeerde lymfocyten en andere stalen, maar niet in volledig bloed, de lever, de spieren, het cerebellum, enz.; Figuur 2.) Dus SLC25A15 is een uitstekende kandidaat voor het gen waarvan de activiteit verandert tussen personen met GG, GA en AA, en daardoor het ziekterisico op ME/CVS verandert.
3D-model van ORNT1
Wat weten we eigenlijk over SLC25A15? Interessant genoeg codeert het een eiwit dat Ornithine Transporter type 1 heet (ORNT1). Dit transporteert ornithine (en ook lysine en arginine) doorheen het binnenste membraan van de mitochondria naar de mitochondriale matrix. Ornithine is een aminozuur (maar niet opgenomen in eiwitten) dat een rol speelt in de ureumcyclus. Deze cyclus speelt een essentiële rol in het verwijderen van ammoniak uit het lichaam (zie punt iv lager).
Deze analyse voorspelt dat als je een letter G op deze positie hebt (Figuur 2):
(i) en als je vrouw bent, je een groter risico hebt op ME/CVS;
(ii) vele van je cellen (bijvoorbeeld in het hart of de hippocampus, maar niet in de spieren of de lever) vaak minder ORNT1-RNA produceren en minder ORNT1-eiwit; en
(iii) in dat geval, ornithine zich dan opstapelt in deze cellen en de algemene mitochondriale functie verstoord zou zijn; en
(iv) ammoniak zich zou ophopen in het bloed.
Sommige van deze voorspellingen komen uit wat we weten over mensen wiens SLC25A15-genen alle twee defect zijn, wat ornithinetranslocasedeficiëntie veroorzaakt (ook bekend als HHH-syndroom). Dit is een ernstige ziekte die vaak leidt tot hyperammoniëmische coma, leerstoornissen en ook lethargie. Een goed overzicht van HHH-syndroom vind je hier.
Dus komen deze voorspellingen overeen met wat anderen hebben gevonden als ze mensen met ME/CVS vergeleken met controlepersonen? Grotendeels wel, maar niet altijd:
(a) Yamano et al. (2016) toonden aan dat er een verhoogde ratio ornithine/citrulline is bij personen met ME/CFS
(b) Naviaux et al. PNAS (2016) vonden dat ornithine middelmatig hoog ligt bij mannen en vrouwen
(c) Armstrong et al. (2012) vonden dan weer het tegenovergestelde, nl. significant verlaagde ornithine (P<0.05) in het bloed van CVS-stalen.
Wat zijn de beperkingen van deze studie?
- Er werd slechts één genomische regio geïdentificeerd, dus om meer te vinden er is een veel grotere studie nodig met ongeveer 20.000 gevallen van ME/CVS.
- Dit verband zou gerepliceerd moeten worden in een onafhankelijke studie.
- We weten niet of mannen met ME/CVS dit genetisch verband vertonen. Er zijn in de UK Biobank 2,4 keer minder mannen met zelfgerapporteerde ME/CVS dan vrouwen, dus een GWAS met enkel mannen heeft veel minder [statistische] kracht om juiste resultaten te vinden.
- Zelfs al is het waar, dan nog zou dit verband het risico op ME/CVS slechts licht verhogen en zeker niet bij alle mensen.
- De ureumcyclus vindt vooral plaats in de mitochondria in levercellen, maar er werden geen verschillen gevonden in SLC25A15-expressie tussen GG, GA en AA in dit orgaan. SLC25A15-expressie gebeurt ook in mindere mate in de pancreas en de dunne darm, maar dat zijn geen belangrijke locaties in de ureumcyclus.
- We weten niet of licht verlaagde niveaus van SLC25A15-RNA (in de aorta, de darm, de hippocampus, getransformeerde lymfocyten en andere stalen) resulteren in lagere niveaus van SLC25A15-eiwit. Dit zou waar moeten zijn, als de hypothese klopt.
- We weten niet of de verschillende observaties over ME/CVS, lymfocytenpercentages en hoornvliesbiomechanica onderling relevant zijn.
- De bevindingen zouden niet gebruikt mogen worden om klinische behandeling te wijzigen zonder een arts te raadplegen.
Wat zijn de sterke punten van de studie?
- Als ze gerepliceerd wordt, zou dit het eerste genetische bewijs worden dat mitochondriale disfunctie (en dan specifiek ornithinetransport) een oorzaak is van vatbaarheid voor ME/CVS (en niet een gevolg van de ziekte ME/CVS).
- Het zou de aandacht van artsen vestigen op deze cellulaire processen voor diagnose en stratificatie van gevallen van ME/CVS.
Met dank aan Ben Neale en zijn lab voor het vrij beschikbaar maken van de resultaten, en aan Simon McGrath voor commentaar en voor het beheren van deze blog.
Chris P. Ponting1, Neil Clark1, Mark Jones2.
1 MRC Institute of Genetics & Molecular Medicine, MRC Human Genetics Unit. 2 UCB Pharma.
Credits Afbeelding: ORNT1 3D computational model, Wang & Chou, 2012.
© Chris Ponting en collega’s voor Simon McGrath, ME/CFS Research Review. Vertaling Abby, redactie Zuiderzon, ME-gids.





