
Door Bronc en Eric Pyrrhus
Al tientallen jaren hebben mensen met myalgische encefalomyelitis/chronisch vermoeidheidssyndroom (ME/cvs) wereldwijd te maken met medische instellingen die vasthouden aan onjuiste wetenschappelijke dogma’s over hun ziekte. Daarnaast is er een schrijnend gebrek aan financiering voor biomedisch onderzoek naar de ziekte.
Gelukkig is er een groeiende groep ruimdenkende wetenschappers die het dogma in twijfel trekt en onderzoek doet om de oorzaken te vinden, een betrouwbare biomarker te ontdekken en effectieve behandelingen te ontwikkelen.
Een van die wetenschappers is Dr. Carmen Scheibenbogen. Dr. Scheibenbogen is hoogleraar klinische immunologie aan het universitair ziekenhuis de Charité in Berlijn. Zij is ook lid van de Biomarkers Working Group van EUROMENE, een Europese non-profitorganisatie die zich inzet voor onderzoek naar ME/cvs.
Wij spraken met Dr. Scheibenbogen om meer te weten te komen over haar onderzoek en over mogelijke nieuwe diagnoses en behandelingen.
De oorspronkelijke bevindingen
In 2015 publiceerden Dr. Scheibenbogen en collega’s een inmiddels klassiek geworden paper waarin werd gemeld dat zij bij 29,5% van de ME/cvs-patiënten verhoogde niveaus van bepaalde antilichamen aantroffen ten opzichte van de niveaus bij gezonde mensen.
Deze antilichamen, die van nature in lage concentraties voorkomen, worden aangetrokken door receptoren op autonome zenuwcellen. Omdat deze antilichamen worden aangetrokken door gewone zenuwcelreceptoren, in plaats van door een infectie, worden deze antilichamen autoantilichamen genoemd.
Dr. Scheibenbogen werkte samen met een bedrijf genaamd CellTrend aan de verfijning van een diagnostische test die verhoogde niveaus van dergelijke antilichamen kan vaststellen.
Autoantilichaam:
Een molecuul gemaakt door het immuunsysteem.
Antilichamen zijn ontworpen om te worden aangetrokken door geïnfecteerde cellen.
Wanneer een antilichaam zich hecht aan een geïnfecteerde cel, kan het immuunsysteem de geïnfecteerde cel herkennen en doden.
Als een antilichaam ten onrechte wordt aangetrokken tot een niet-geïnfecteerde cel, wordt het een autoantilichaam genoemd.
In een publicatie uit 2021 gebruikten Dr. Scheibenbogen en collega’s de test van CellTrend om naar een verband tussen de niveaus van deze antilichamen en de symptomen van ME/cvs te zoeken. Ze vonden dat niveaus van sommige antilichamen samenhingen met vermoeidheid en spierpijn bij patiënten met een door infectie getriggerd begin, maar niet bij patiënten zonder een door infectie getriggerd begin.
Een mogelijke behandeling?
Wat gebeurt er bij patiënten met verhoogde niveaus van deze antilichamen als je deze niveaus probeert te verlagen? Om daar achter te komen voerden Dr. Scheibenbogen en collega’s een kleine proefstudie uit bij 10 patiënten met verhoogde niveaus van antilichamen die worden aangetrokken door een specifieke receptor op autonome zenuwcellen.
In deze studie gebruikten zij een proces, dat immunoadsorptie wordt genoemd, om het totale niveau van alle antilichamen bij deze patiënten tijdelijk te verlagen.
De immunoadsorptie verminderde bij negen van de tien patiënten aanzienlijk het niveau van antilichamen die werden aangetrokken door de specifieke receptor.
Na de immunoadsorptie werd het totale niveau van antilichamen bij de studiepatiënten weer op een normaal niveau gebracht door de patiënten een dosis nieuwe antilichamen toe te dienen via een intraveneuze immunoglobulinetransfusie (IVIG).
Immunoadsorptie:
Immunoadsorptie is een proces waarbij wordt geprobeerd de hoeveelheid antilichamen in een patiënt te verminderen door de volgende stappen:
1. Bloed wordt eerst bij de patiënt afgenomen en door een filter geleid.
2. Een kleverige coating aan de binnenkant van de filter vangt antilichamen op.
3. Het bloed wordt dan teruggegeven aan de patiënt.
Negen van de tien patiënten vertoonden vóór de IVIG-transfusie een significant verlaagd niveau van antilichamen tegen de specifieke receptor. Zeven van de negen patiënten meldden een verbetering van de symptomen na de IVIG-transfusie. Drie van die zeven patiënten meldden dat hun verbetering ten minste een jaar aanhield, maar de rest herviel allemaal binnen een jaar.
In een vervolgstudie werden vijf van de patiënten uit de oorspronkelijke pilootstudie – die verbetering van de symptomen hadden gemeld, maar vervolgens terugvielen – ongeveer twee jaar later opnieuw behandeld met een licht gewijzigd behandelingsschema. Vier van de vijf patiënten meldden opnieuw verbetering van de symptomen, maar één niet. De verbetering van de symptomen duurde ongeveer 6-12 maanden.
Waar ontstaat auto-immuniteit?
Antilichamen worden door het immuunsysteem aangemaakt om specifiek te reageren op infecties. Als iemand verhoogde niveaus van antilichamen heeft die zich richten op gewone zenuwcelreceptoren, in plaats van op een infectie, is dat een vorm van auto-immuniteit.
Maar hoe kan een dergelijke auto-immuniteit überhaupt ontstaan? Waardoor kan het aantal antilichamen hoger worden dan bij een gezond persoon?
Immunologen hebben een paar verschillende mogelijkheden voor dit type auto-immuniteit ontdekt. Van deze mogelijkheden worden twee scenario’s het meest waarschijnlijk geacht: epitoopverspreiding en moleculaire nabootsing. Beide scenario’s worden in gang gezet door een infectie.
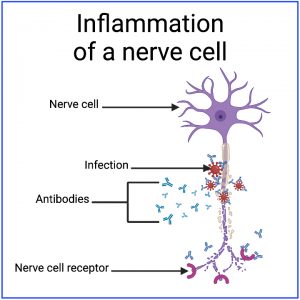
Een infectie leidt er doorgaans toe dat het immuunsysteem antilichamen aanmaakt die specifiek gericht zijn tegen de infectie, wat leidt tot een ontsteking rond de infectie.
Tijdens dit proces kunnen sommige geïnfecteerde cellen openbreken, waardoor hun inhoud vrijkomt. Bovendien kan de ontsteking bijkomende schade veroorzaken aan de omliggende cellen, die ook openbreken en hun inhoud vrijgeven.
Bij epitoopverspreiding leidt deze ontsteking tot de ontwikkeling van antilichamen die worden aangetrokken door gewone menselijke moleculen in de buurt van de infectie, in plaats van aangetrokken door de infectie zelf.
Als er al een laag niveau van dergelijke antilichamen is, kan epitoopverspreiding een versterking van deze antilichamen veroorzaken – zodat deze antilichamen ofwel in aantal toenemen ofwel sterker worden aangetrokken door het gewone menselijke molecuul.
Bijvoorbeeld, een infectie in de buurt van (of zelfs in) een autonome zenuwcel zou antilichamen genereren die specifiek worden aangetrokken door de infectie. Maar de ontsteking rond de infectie zou de autonome zenuwcel kunnen opslokken – mogelijk leidend tot een verhoogd niveau van antilichamen die worden aangetrokken door reguliere receptoren op de zenuwcel.
Bij moleculaire nabootsing leidt een infectie ertoe dat het immuunsysteem antilichamen ontwikkelt die zijn ontworpen om te worden aangetrokken door de infectie, maar die toevallig ook worden aangetrokken door wat normaal menselijk weefsel.
In dit geval zijn de antilichamen zo ontworpen dat ze worden aangetrokken door een specifieke molecule van de infectie. De vorm van deze specifieke molecule lijkt echter toevallig op de vorm van een andere molecule die in normaal menselijk weefsel voorkomt.
Omdat de vormen van de twee moleculen toevallig zo op elkaar lijken, kunnen antilichamen geen onderscheid maken tussen de twee moleculen en worden ze tot beide aangetrokken.
Epitoopverspreiding:
Ontsteking leidt tot de aanmaak van antilichamen die worden aangetrokken tot gewone menselijke moleculen in de buurt van de infectie, in plaats van aangetrokken tot de infectie zelf.
Moleculaire nabootsing:
Een infectie leidt tot de aanmaak van antilichamen die zijn ontworpen om te worden aangetrokken tot de infectie, maar die toevallig ook worden aangetrokken tot een of ander regulier menselijk weefsel.
Een virus kan bijvoorbeeld een specifiek molecuul hebben dat toevallig dezelfde vorm heeft als een gewone zenuwcelreceptor. Wanneer een persoon met het virus wordt besmet, zullen bestaande antilichamen die worden aangetrokken door gewone zenuwcelreceptoren, ook door het virus worden aangetrokken. Het immuunsysteem zal dan proberen het virus te bestrijden door meer van deze antilichamen te maken – wat leidt tot een verhoogd niveau van antilichamen die worden aangetrokken door reguliere receptoren op zenuwcellen.
Dr. Scheibenbogen verduidelijkt het verder
Wij spraken met Dr. Scheibenbogen in de zomer om meer te weten te komen over haar onderzoek. Het volgende is een uittreksel van dat gesprek.
Phoenix Rising:
Hoe bent u betrokken geraakt bij het onderzoek naar ME/cvs?
Dr. Scheibenbogen:
Wel, omdat ik de verantwoordelijkheid kreeg voor deze patiënten. Ik ben opgeleid in hematologie/oncologie en daar heb ik tot 15 jaar geleden in gewerkt. En toen kreeg ik de leiding over een kliniek voor patiënten met immunodeficiëntie, en in deze kliniek was er ook een kliniek voor patiënten met ME/cvs-patiënten.
Op dat moment wist ik niet veel over de ziekte, maar ik zag al snel dat er iets helemaal mis was met deze patiënten. Destijds werden deze patiënten namelijk beschouwd als psychosomatisch of lijdend aan een soort depressie, en ze werden beschouwd als rare, moeilijke patiënten. Ik zag in dat dit helemaal niet juist was.
Er waren veel jonge patiënten die echt weer gezond wilden worden, en daar alles voor over hadden. Ze waren niet depressief. Ze hadden gewoon te maken met een zeer moeilijke situatie. Toen besloot ik “oké, aangezien we in Duitsland zo weinig weten, laten we eens rondkijken in de wereld,” in de veronderstelling dat andere mensen meer zouden weten.
Toen zag ik iets wat ik niet kon geloven – dat deze ziekte wereldwijd niet goed werd begrepen en dat er op dat moment geen behandeling voor deze patiënten bestond.
Dat was werkelijk een grote verrassing voor mij, komende uit de hematologie/oncologie waar al 15 jaar zoveel bekend is, en waar gepersonaliseerde geneeskunde al beschikbaar was. Het was een schok voor mij dat we deze ernstige en veel voorkomende ziekte vergeten waren.
Toen besloot ik dat ik mijn verantwoordelijkheid moest nemen – niet alleen om meer te weten te komen over de ziekte en hoe we de patiënten kunnen helpen – maar ook om te proberen de farmaceutische industrie ertoe te bewegen medicijnen te ontwikkelen.
Het probleem was destijds dat er niet veel kennis was over het mechanisme van de ziekte. Dus keek ik rond en ik zag dat er in Noorwegen twee actieve oncologen waren, Øystein Fluge en Olav Mella, en ik bezocht hen – en eigenlijk was dat mijn startpunt om onderzoek te doen naar de rol van autoantilichamen bij ME/cvs.
Ik denk echt dat de tijd nu aan het veranderen is, en dat we echt vrij snel therapieën kunnen ontwikkelen. Mijn grote hoop is dat we binnen enkele jaren therapieën zullen hebben waarmee de meeste patiënten kunnen worden behandeld.
Phoenix Rising:
In een vorig jaar gepubliceerde studie hebben u en uw collega’s gezocht naar verbanden tussen antilichaamniveaus en symptomen bij ME/cvs.
U vond dat de niveaus van sommige antilichamen – die worden aangetrokken tot autonome zenuwcelreceptoren – aanzienlijk correleerden met symptomen van vermoeidheid en spierpijn bij patiënten met een door infectie getriggerd begin, maar niet bij patiënten zonder een door infectie getriggerd begin.
Denkt u dat deze antilichamen bij patiënten met een door infectie getriggerd begin kunnen bijdragen tot een ontregeling van het autonome zenuwstelsel – misschien een bijdrage tot de bloedvatdysautonomie die ten grondslag ligt aan zowel orthostatische intolerantie als aerobe inspanningsintolerantie?
Dr. Scheibenbogen:
Laat me eerst iets uitleggen over deze antilichamen en wat er anders aan is. Wat we weten is dat dit zogenaamde natuurlijke antilichamen zijn, dus eigenlijk hebben we allemaal dergelijke antilichamen, en deze antilichamen helpen ons belangrijke functies te controleren.
Een van deze functies is in het autonome zenuwstelsel, waar we twee belangrijke spelers hebben:
- Adrenaline, ook bekend als epinefrine, die adrenerge receptoren op autonome zenuwcellen activeert, en de stressreacties bemiddelt.
- Acetylcholine, dat cholinerge receptoren op autonome zenuwcellen activeert.
De antilichamen, die worden aangetrokken door receptoren van autonome zenuwcellen, lijken te veranderen tijdens ziekten – niet alleen bij ME/cvs, maar ook bij auto-immuunziekten en neurodegeneratieve ziekten zoals de ziekte van Alzheimer.
De eerste dergelijke ziekte, die al meer dan 20 jaar geleden werd bestudeerd, was een hartziekte genaamd gedilateerde cardiomyopathie. Bij deze ziekte werden deze autoantilichamen voor het eerst beschreven.
Nu wordt het vrij snel duidelijk, als je te maken hebt met ME/cvs-patiënten, dat zij lijden aan ernstige autonome ontregeling.
Dus alles wat je automatisch doet (via de autonome zenuwen) – zoals het kloppen van je hart, je ademhaling, het transport van je bloed naar je spieren als je rent, of naar je hersenen als je denkt – werkt niet goed bij deze patiënten.
Iets anders wat voor een immunoloog heel duidelijk is, is dat immuunontregeling een belangrijke rol speelt bij deze ziekte, omdat de ziekte wordt uitgelokt door een infectie en we weten dat infecties het immuunsysteem sterk stimuleren.
Bij veel patiënten kan het na een infectie een tijdje duren voordat het immuunsysteem weer tot rust komt en dat is een gevaarlijk moment om auto-immuniteit te ontwikkelen.
Ook hebben we aanwijzingen dat sommige patiënten al andere auto-immuunziekten hebben, bijvoorbeeld schildklierontsteking. Ze vertellen allemaal dat auto-immuunziekten in hun familie voorkomen. Daarom was het niet zo moeilijk om deze twee bevindingen samen te voegen, en te denken “oké, dit kan een auto-immuunziekte zijn.”
Dus, als je denkt dat ME/cvs een auto-immuunziekte is – wat is dan het doelwit? Het is niet onwaarschijnlijk dat het doelwit het autonome zenuwstelsel is, omdat het zo sterk ontregeld is. Er is geen duidelijk ander doelwit in deze ziekte. We hebben geen ontstoken gewrichten, geen organen die het doelwit zijn.
Het was voor mij niet zo moeilijk om deze antilichamen te bestuderen omdat, zoals ik al zei, sommige onderzoekers dergelijke antilichamen tegen adrenalinereceptoren al meer dan twee decennia bestudeerden.
Daarom ben ik ook begonnen met het analyseren van autoantilichamen die worden aangetrokken door deze adrenalinereceptoren of aangetrokken door de acetylcholinereceptoren, bij ME/cvs-patiënten.
Dat was een studie die werd gepubliceerd in 2016 waarin we vonden dat we een subgroep van patiënten hadden die meer antilichamen hadden die werden aangetrokken tot een van de adrenaline receptoren, of meer antilichamen die werden aangetrokken tot een van de acetylcholine receptoren. Dat was voor mijn groep het uitgangspunt om zich meer op deze antilichamen te richten.
Terugkomend op uw vraag – welke rol spelen deze antilichamen bij de ontregeling van het autonome zenuwstelsel? Ik denk dat ze een belangrijke rol spelen, hoewel het niet zo gemakkelijk is te bewijzen dat deze antilichamen leiden tot deze ontregeling bij mensen.
Eén manier om de rol van deze antilichamen te bestuderen is met geïsoleerde cellen in het laboratorium, en dat is wat wij deden. We analyseerden cellen die deze receptoren hadden en we toonden aan dat als we deze cellen mengen met bloed van patiënten, de respons van de cel op adrenalinestimulatie verandert.
We gebruikten ook genetisch gemodificeerde muizen, die deze receptoren volledig missen, om deze bevindingen te bevestigen. Dat is een andere studie die in 2020 is gepubliceerd, over de functie van deze receptoren.
Een andere manier om de functie van deze antilichamen te bestuderen is te kijken of de niveaus van de antilichamen correleren met de ernst van de symptomen bij patiënten. Dat is wat we deden in de paper die u net noemde.
We vonden correlaties met vermoeidheid, met spierpijn, ook met de ernst van de ziekte zoals beoordeeld door de Bell-score, met cognitieve stoornissen. Wij hebben in deze studie alleen de autonome functie geanalyseerd met behulp van de COMPASS-vragenlijst en daar konden wij geen sterke correlatie vinden.
Maar waar we zeer van overtuigd zijn, is dat een van de grote problemen van deze antilichamen is dat de doorbloeding wordt belemmerd, omdat adrenalinereceptoren een belangrijke rol spelen bij de verdeling van je bloed door het lichaam.
Je kunt de hoeveelheid bloed die je hebt niet verhogen, maar als je gaat rennen, heb je veel meer bloed nodig in je spieren. Daarom moeten je autonome zenuwen het bloed herverdelen, weg van de darmen of weg van de hersenen. Werkt deze herverdeling niet goed, dan krijgen je spieren niet genoeg bloed.
Evenzo, als je niet meer bloed in je hersenen herverdeelt terwijl je praat, dan kun je je niet goed concentreren en kun je last krijgen van hersenmist. Wij denken dat de autonome regulering van de bloedvaten ernstig verstoord is bij ME/cvs, en dit kan een van de grootste problemen zijn die deze autoantilichamen veroorzaken.
Phoenix Rising:
Hoe meer onderzoek naar auto-immuniteit er is, hoe verder we verwijderd raken van het psychosomatische discours of de suggestie van depressie, dus het is zeer bemoedigend dat te horen.
Dr. Scheibenbogen:
Nog een opmerking – dit zijn natuurlijke antilichamen. Het is niet alleen het aantal antilichamen dat ons vertelt dat ze niet goed werken. Het is ook hun functie, die niet noodzakelijk verband houdt met het aantal antilichamen.
Daarom is het moeilijker om de rol van deze antilichamen te bestuderen in vergelijking met andere, eenvoudigere autoantilichamen – die er alleen zijn als je een ziekte hebt, en er niet zijn als je gezond bent.
Phoenix Rising:
Denkt u dat deze toegenomen antilichamen bij patiënten kunnen ontstaan als reactie op een infectie in de autonome zenuwen zelf, misschien via epitoopverspreiding?
Dr. Scheibenbogen:
Wij denken dat er twee mechanismen mogelijk zijn. De ene is het verspreiden van epitopen.
Maar wat betekent epitoopverspreiding? Bij een infectie proberen al je immuuncellen het virus kwijt te raken. Je hebt het immuunsysteem dat bepaalde ontstekingsmoleculen aanmaakt, je hebt je T-cellen die geïnfecteerde cellen vernietigen, en je hebt je B-cellen.
Deze B-cellen produceren antilichamen die zich specifiek aan het virus binden en het virus proberen te neutraliseren. Als je voor de eerste keer een infectie hebt, binden deze antilichamen niet goed. Als je een voortdurende infectie hebt, of als je een tweede infectie met hetzelfde virus hebt, dan probeert je immuunsysteem betere antilichamen te maken.
B-cellen kunnen dus spelen met de structuur van hun antilichamen, en de B-cellen die antilichamen maken die beter binden, hebben een overlevingsvoordeel.
Wanneer je een infectie hebt, kan het immuunsysteem zich niet perfect richten op alleen de infectie, dus heb je altijd wat nevenschade. Behalve B-cellen die antilichamen maken die worden aangetrokken door de infectie, heb je ook B-cellen die antilichamen maken die worden aangetrokken door andere structuren, en dat kunnen ook B-cellen zijn die antilichamen maken die worden aangetrokken door je eigen lichaamsweefsel.
Als je al B-cellen hebt die antilichamen produceren die worden aangetrokken door adrenalinereceptoren, dan kan het gebeuren dat je antilichamen maakt die sterker binden aan adrenalinereceptoren, of die een beetje anders binden – en dit kan een complete verandering in de functie van de adrenalinereceptor veroorzaken.
De andere mogelijkheid (en nogmaals sorry, immuniteit is complex) heet moleculaire nabootsing. Wat betekent dit?
We weten dat veel virussen en bacteriën structuren hebben die overeenkomsten vertonen met structuren van onze eigen weefsels. Gewoonlijk hebben we geen immuuncellen die antilichamen produceren die zich aangetrokken voelen tot onze eigen weefsels, en als we zulke immuuncellen wel hebben, worden ze meestal afgeremd.
Maar het kan zijn dat wanneer je een immuunreactie hebt tegen een virus, dat je zo’n sterke antilichaamreactie oproept tegen een virale structuur, dat dit antilichaam vervolgens een kruisreactie aangaat met een structuur uit je eigen weefsels. Omdat deze immuunrespons zo sterk is, kan dit antilichaam schade aanrichten.
We hebben net een studie gepubliceerd waarin we de antilichaamrespons tegen EBV-eiwitten hebben geanalyseerd. Het Epstein-Barrvirus (EBV) is een virus waarvan bekend is dat het ME/cvs uitlokt bij een subgroep van patiënten, en dit is een vrij groot virus met vele, vele virale eiwitten.
We hebben deze eiwitten in duizenden stukjes geknipt en vervolgens de antilichaamrespons tegen al deze stukjes geanalyseerd, in de hoop enkele stukjes te vinden die wel werden herkend door antilichamen van patiënten met ME/cvs, maar niet door antilichamen van gezonde mensen.
Dus hoopten we een stukje van het virus te vinden dat antilichamen van ME/cvs-patiënten aantrekt. Eigenlijk is dat wat we vonden. Dit project was al 10 jaar geleden begonnen. De eerste gegevens publiceerden we enkele jaren geleden en deze gegevens waren nogal frustrerend omdat we toen niet zoveel verschil vonden tussen patiënten en gezonde mensen.
Recentelijk hebben we deze gegevens opnieuw geanalyseerd. We beschikken nu over moderne bio-informaticatechnologieën, en wat we nu vonden is dat we twee stukken van deze EBV-eiwitten konden identificeren die antilichamen aantrokken bij de meerderheid van de ME/cvs-patiënten.
We ontdekten dat veel ME/cvs-patiënten een sterkere antilichaamrespons hebben op één deel van het EBV-virus, de zogenaamde polyarginineregio. Door een moderne bio-informatische analyse te doen en te kijken naar sequentiehomologieën, ontdekten we dat er verschillende structuren in de eiwitten van ons eigen lichaam zijn die erop lijken – waaronder adrenalinereceptoren en mitochondriale eiwitten.
Het andere interessante is dat deze polyarginineregio niet specifiek is voor EBV, maar ook voorkomt in andere virussen – bijvoorbeeld enterovirussen of humane papillomavirussen (HPV), waarvan ook bekend is dat ze ME/cvs uitlokken.
Daarom vinden we dit een zeer belangrijke bevinding omdat het een eerste aanwijzing geeft van moleculaire nabootsing. Bovendien kan het gaan om een antilichaam dat nuttig kan zijn voor de ontwikkeling van een diagnostische test.
We bestuderen momenteel andere cohorten om dit te bevestigen, en gaan ook dieper in op de vraag of we kunnen bevestigen dat er werkelijk sprake is van moleculaire nabootsing, en of deze antilichamen dan ook de functie van de adrenalinereceptoren veranderen. Als we dit echt kunnen bewijzen, dan zou dit zeer overtuigend zijn dat we ons op deze antilichamen moeten richten.
We waren erg blij en enthousiast over de ontdekking hiervan. Het was eigenlijk heel frustrerend, het was veel werk en we hadden zo weinig succes enkele jaren geleden en ik was er eigenlijk zo van overtuigd dat we binnen de EBV-signatuur een antwoord zouden vinden – een potentieel doelwit van auto-immuunreacties.
Nu denk ik dat dit behoorlijk overtuigende resultaten zijn. Natuurlijk moeten we meer studies doen, maar dit is een zeer belangrijk uitgangspunt.
Phoenix Rising:
In 2018 en 2020 publiceerde u twee papers waarin u pogingen onderzocht om deze antilichamen te verwijderen door een therapie die immunoadsorptie heet. Kunt u uitleggen hoe deze therapie werkt en hoe succesvol die is?
Dr. Scheibenbogen:
Dus, uitgaande van ons concept dat autoantilichamen een belangrijke rol spelen bij ME/cvs en de ziekte veroorzaken, zochten wij naar therapieën.
Velen van u kennen het Rituximab-verhaal – dat de Noren in twee kleinere studies succesvol waren in de behandeling van patiënten en vervolgens in een grote studie de werkzaamheid niet konden aantonen. De grote studie had verschillende problemen. Een belangrijke was dat ze niet dezelfde dosis konden geven wegens een tekort aan geld.
Om de therapieën verder te ontwikkelen, waagden we een kans op de techniek van immunoadsorptie, een soort aferese waarbij je bepaalde eiwitten rechtstreeks uit het bloed van patiënten wast.
Eigenlijk is het vergelijkbaar met dialyse. Je laat het bloed van de patiënt door een machine lopen. In de machine worden de cellen in het bloed gescheiden van het plasma, de patiënten krijgen de cellen terug, en dan loopt het plasma door een filter. In die filter blijven de antilichamen plakken. We wassen dus alle antilichamen uit het plasma en geven het plasma ook terug aan de patiënten.
Dit is een techniek die eigenlijk een Duitse ontwikkeling is en al tientallen jaren wordt gebruikt voor de behandeling van autoantilichaam-gemedieerde ziekte en ook om antilichamen kwijt te raken bij orgaantransplantaties.
Wat we zagen was heel indrukwekkend, want verschillende van deze patiënten werden binnen een paar dagen snel beter. De eerste punten die beter werden waren het grieperige gevoel, gewrichtspijn en spierpijn. Eigenlijk duurde de vermoeidheid langer. Cognitieve stoornissen waren veel beter na een week. We hadden dus verschillende patiënten met echt indrukwekkende reacties.
Natuurlijk was dit geen gecontroleerde studie, dus er is altijd het placebo-effect. Op dat moment konden we het bedrijf echter niet overtuigen om een vervolgstudie te doen als een placebogecontroleerde studie.
We moesten wachten tot de coronaviruspandemie. Nu werken we samen met de neurologen van ons ziekenhuis, om opnieuw een studie met immunoadsorptie voor te bereiden – nu bij ME/cvs en post-COVID-ME/cvs-patiënten.
We gaan ook herhaalde immunoadsorptie bestuderen, omdat we weten dat we met slechts één week therapie de ziekte niet kunnen genezen. We denken dat we het nog twee keer moeten herhalen.
Phoenix Rising:
Wat voor onderzoek is er nog nodig naar mogelijke behandelingen van ME/cvs?
Dr. Scheibenbogen:
Onze volgende stap is om zowel klinische studies als meer gedetailleerd onderzoek te doen.
We hebben dringend therapieën nodig, en door klinische studies te doen kunnen we ook veel leren over ziektemechanismen. Wij doen deze klinische proeven en doen ook veel biomarkeranalyses bij deze patiënten voor en na de therapie. Op deze manier kunnen we zowel therapieën ontwikkelen als meer leren over de ziekte.
Er is nog een ander probleem van de bloedvaten, endotheeldisfunctie genaamd, dat de laatste jaren door verschillende groepen is aangetoond. Endotheeldisfunctie kan leiden tot een verminderde bloedstroom en zou ook een aantal van de ziektesymptomen kunnen verklaren. Autoantilichamen kunnen deze endotheeldisfunctie veroorzaken.
Wij zullen ook een studie starten met een geneesmiddel dat de bloedvatdisfunctie aanpakt. Dit geneesmiddel is afkomstig van de behandeling van hart- en vaatziekten. Hyperbare zuurstoftherapie, die sommige patiënten met Long COVID kan helpen, is iets wat we misschien ook nader zullen bestuderen.
Natuurlijk zullen we ook veel meer onderzoek doen naar de functie van deze autoantilichamen tegen adrenalinereceptoren.
En we zijn blij dat we nu financiering hebben van de Duitse overheid, zodat we dit onderzoek kunnen gaan uitvoeren binnen een netwerk van vijf verschillende universiteiten in Duitsland. We zullen alle verschillende aspecten bestuderen van hoe ze autonome functies reguleren, en hoe ze mitochondriale functies reguleren. Bhupesh Prusty zal een van onze partners zijn en we zullen ook bestuderen hoe ze het immuunsysteem reguleren.
Phoenix Rising:
Hier in het Verenigd Koninkrijk heeft het National Institute of Clinical Excellence nieuwe richtlijnen uitgegeven voor medische professionals over hoe ME/cvs-patiënten te diagnosticeren en te behandelen. Deze hebben schadelijke psychologische therapieën zoals graduele oefentherapie geschrapt.
Welke aanpak hanteren volksgezondheidsautoriteiten in Duitsland ten aanzien van de zorg voor mensen met ME/cvs?
Dr. Scheibenbogen:
In Duitsland hebben we geen richtlijnen voor de behandeling van ME/cvs. We hebben alleen richtlijnen over vermoeidheid, over diagnose en management van vermoeidheid.
Binnen deze richtlijnen is er een hoofdstuk over ME/cvs – dat eigenlijk verschrikkelijk was omdat het beweerde dat ME/cvs waarschijnlijk helemaal geen ziekte is, en dat er heel weinig bewijs voor is, dat het een psychosomatische ziekte is en al die stomme dingen over studies naar graduele oefentherapie en cognitieve gedragstherapie.
Deze worden nu herzien en zullen vrij snel weer gepubliceerd worden. We hadden het geluk dat zowel Uta Behrends – die ME/cvs-specialist is voor kinderen en jongeren in Duitsland – als ikzelf aan dit hoofdstuk bijdragen. Nu zijn we het voor minstens 90% eens met wat er is geschreven, en alle patiëntengroepen is gevraagd een bijdrage te leveren.
Dit is heel belangrijk omdat dit de richtlijnen zijn die breed worden gebruikt en samen met de richtlijnen die we hebben over de aanpak van Long COVID, waarin ook ME/cvs wordt besproken, bereikt dit nu veel artsen.
Er zijn nog steeds mensen die denken dat ME/cvs zoiets is als een burn-out, evenals mensen die nu beweren dat ME/cvs alleen tussen de oren zit en geen ziekte is – maar dat worden er steeds minder.
Er zijn nu veel artsen die weten wat ME/cvs is, en die weten wat PEM is – wat vijf jaar geleden bijna niemand wist. We hebben nu veel opleidingsprogramma’s en schrijven veel artikelen over ME/cvs, en dat is echt een grote verandering.
Phoenix Rising:
Kunt u ons iets vertellen over uw huidige onderzoek naar ME/cvs?
Dr. Scheibenbogen:
We zijn erg blij dat we nu een gezamenlijke onderzoeksgroep hebben. Ons labo in Berlijn zal zich nu specifiek richten op de bevindingen die we hadden bij EBV.
We zullen de mogelijke moleculaire nabootsing van EBV met de adrenalinereceptoren, maar ook met andere eiwitten, nader bestuderen. We zullen dit bestuderen op moleculair en op functioneel niveau, in de hoop dat we hieruit een goede diagnostische test kunnen halen. Het zou geweldig zijn als we een eenvoudige antistoffentest hadden waarbij we een antistof detecteren die specifiek is voor ME/cvs.
Voor het andere grote project proberen we momenteel een platform voor therapieën te ontwikkelen. Onlangs kregen we de aankondiging dat de Duitse regering financiering geeft voor een platform om klinische proeven te doen bij ME/cvs en Long COVID.
Dit platform komt in het universitair ziekenhuis de Charité, omdat we hier de beste kennis hebben over hoe ME/cvs te diagnosticeren, hoe de ernst van de symptomen te beoordelen, hoe klinische studies te doen en we zullen ook een biomarkerplatform hebben.
We zullen verschillende centra in Duitsland hebben die klinische studies gaan doen. Omdat we proberen zo snel mogelijk therapieën te ontwikkelen, zullen we ons richten op therapieën waarvoor al een vergunning is verleend voor de behandeling van andere ziekten. Omdat we dan veel sneller therapieën kunnen ontwikkelen.
Wij willen ook meer te weten komen over welke patiënten baat zullen hebben bij welke therapieën, omdat we ervan overtuigd zijn dat er niet slechts één therapie zal zijn die alle patiënten zal helpen.
Net als bij andere ziekten zijn er misschien meerdere geneesmiddelen nodig, omdat we denken dat er waarschijnlijk verschillende fasen van de ziekte zijn. Of waarschijnlijk zijn er ook patiënten bij wie autoantilichamen niet zo’n belangrijke rol spelen of helemaal geen rol spelen.
Door grondig biomarkeronderzoek zullen we hopelijk leren voorspellen welke patiënten op welke therapie zouden reageren. Uiteindelijk hopen we dat we over vijf jaar een portefeuille van verschillende therapieën zullen hebben en dat we echt aan gepersonaliseerde behandeling kunnen doen, zoals we nu al doen bij andere therapieën.
Ik denk dat dit binnen een paar jaar werkelijkheid kan worden en dat komt natuurlijk door de enorme impact die Long COVID heeft gemaakt. Want dat heeft echt geleid tot de verandering waardoor we financiering konden krijgen. Zonder financiering en zonder steun van de farmaceutische industrie was het de afgelopen tien jaar erg moeilijk om wereldwijd klinische studies te doen en daar komt nu verandering in.
Phoenix Rising:
Gefeliciteerd met het goede nieuws over de financiering. Dit geeft ons weer hoop. Dank u voor al het werk dat u doet.
Dr. Scheibenbogen:
We kunnen nu echt hoop hebben want niet alleen wij in Duitsland, ook de NIH hebben net een oproep gedaan voor financiering van klinische studies bij Long COVID. De ernstigste Long COVID-patiënten lijken te lijden aan ME/cvs, dus uiteindelijk gaat het ook om de ontwikkeling van therapieën voor ME/cvs.
Opmerking: Het bovenstaande artikel is gebaseerd op een gesprek met Dr. Scheibenbogen op 1 juni 2022. U kunt beide delen van het gesprek hier bekijken:
Interview met Dr. Carmen Scheibenbogen: Deel 1
Interview met Dr. Carmen Scheibenbogen: Deel 2
Dankbetuiging: Bronc bedankt zijn dochter voor het afnemen van het interview en zijn vrouw voor het uitschrijven van het interview.
Bronc is een voormalig historicus die actief is in zijn lokale ME-steungroep. Hij interviewt graag wetenschappers die betrokken zijn bij ME-onderzoek om zichzelf en anderen te helpen hun ziekte beter te begrijpen.
Eric Pyrrhus is een wetenschapper met interesse in flavivirussen, coronavirussen en beeldvormingstechnologie. Met een bacheloropleiding aan Columbia University en de University of Pennsylvania, en een masteropleiding aan U.C. Berkeley en UCSF Medical School, heeft hij biomedische wetenschappen, bio-informatica, biomedische beeldvorming, biosensoren, computerwetenschappen, kunstmatige intelligentie en bedrijfskunde gestudeerd.
© Phoenix Rising, 13 december 2022. Vertaling ME/cvs Vereniging, redactie ME-gids.







