In 2025 hebben wetenschappers een belangrijke stap gezet in het begrijpen van de pathofysiologie van ME/cvs. Het is misschien geen doorbraak, maar we ontdekken wel meer stukjes van de puzzel. Het is alsof je de hoeken en de buitenste rand op hun plaats legt: we kunnen nog niet zien wat de puzzel precies inhoudt, maar we beginnen wel een glimp op te vangen van wat hij zal onthullen.
Laten we onze jaarlijkse traditie voortzetten en de meest interessante ME/cvs-onderzoeken van het jaar bespreken. Kijk of u het eens bent met onze optimistische beoordeling.
Dit is alweer het zesde jaar dat we dit jaarlijkse overzicht maken. Eerdere edities kunt u hier lezen: 2024, 2023, 2022, 2021, 2020.

Genetica
Decode ME
2025 was het jaar van het gen. We hadden genetische studies naar receptoren van naturalkillercellen, herpesvirussen, metabolisme, cytokines en het Olduvai-domein. Er was echter één studie die alle andere overschaduwde: DecodeME.
DecodeME is de grootste ME/cvs-studie ooit uitgevoerd; meer dan 15.000 mensen in het Verenigd Koninkrijk namen deel door hun DNA per post op te sturen. Hun genetische code werd vergeleken met die van 250.000 controles. De resultaten tonen aan dat ME/cvs een bescheiden erfelijkheidsgraad heeft. Genen kunnen het risico op het ontwikkelen van de ziekte verhogen, maar ze spelen een minder grote rol dan bijvoorbeeld bij schizofrenie, de ziekte van Crohn of diabetes type 1. Verdere analyse door PrecisionLife suggereert dat ME/cvs ook sterk polygeen is, wat betekent dat het risico op het krijgen van de ziekte verdeeld is over veel verschillende genen, die elk slechts een klein effect hebben.
Het hebben van een of meerdere van deze DNA-varianten is niet zo belangrijk. Ze verhogen het risico op ME/cvs slechts minimaal. Het gaat erom waar ze naar wijzen, want dat vertelt ons iets over de biologische mechanismen die ME/cvs veroorzaken. In DecodeME wijzen de meeste signalen naar de hersenen. Het gaat onder andere om genen zoals CA10, SHISA6, SOX6, LRRC7 en DCC, die betrokken zijn bij de ontwikkeling van neuronen en de communicatie in de hersenen. Voor wie meer wil weten, hebben we twee artikelen over DecodeME geschreven: een waarin de methoden en belangrijkste resultaten worden samengevat, en een waarin de genen die betrokken zijn bij ME/cvs worden geanalyseerd.
Zeldzame mutaties
Vóór DecodeME bestond er al een fascinerende genetische studie die veel opwinding en discussie had veroorzaakt. Het team van Mark Snyder aan de Stanford University hanteerde een andere aanpak, maar kwam tot vergelijkbare resultaten.
DecodeME onderzocht veelvoorkomende DNA-varianten die een kleine invloed hebben op de hoeveelheid eiwit die wordt aangemaakt. De effecten zijn klein en geleidelijk, alsof je een volumeknop opendraait. De groep van Snyder richtte zich echter op zeldzame DNA-varianten die meer ingrijpende gevolgen hebben, zoals het aanmaken van een defect eiwit dat niet langer goed functioneert.
De steekproefomvang was te klein om al deze zeldzame mutaties te detecteren, dus voegden de onderzoekers van Stanford een neuraal netwerk toe dat getraind was op biologische gegevens zoals eiwitinteracties. Het zou genen in netwerken kunnen indelen op basis van hun functie. Hierdoor kon de analyse aangeven welke netwerken waarschijnlijk betrokken zijn bij de pathologie van ME/cvs. Een van de belangrijkste antwoorden was: synaptische functie, oftewel hoe neuronen met elkaar communiceren. Dit komt vrij goed overeen met de resultaten van DecodeME.
Er zijn natuurlijk wel beperkingen aan deze genetische studies. De steekproefgrootte van de Snyder-studie was klein (slechts 247 ME/cvs-patiënten), terwijl DecodeME slecht reproduceerbaar bleek in andere genetische databases zoals de UK Biobank. Desondanks leverden deze studies ons een belangrijk stukje van de puzzel op. Theorieën over ME/cvs zullen deze genetische aanwijzingen moeten integreren, wat suggereert dat de hersenen en neurale communicatie een cruciale rol spelen.
Immunologie
Jacht op virussen
DecodeME en de studie van Snyder lieten ook genetische signalen zien die naar het immuunsysteem wezen. Helaas leverden de meeste immunologische studies in 2025 geen significante resultaten op.
Laten we beginnen met de zoektocht naar virussen en andere ziekteverwekkers. Dit jaar publiceerde het team van Ronald Davis, dat onderzoek deed naar ernstig zieke patiënten, eindelijk de resultaten van virussequentiebepaling. Ze onderzochten 185 menselijke virussen in het bloed, maar vonden slechts sporen van 17. Deze kwamen niet vaker voor bij patiënten dan bij controlegroepen. Sterker nog, de auteurs schreven dat “verrassend genoeg meer virussen werden gevonden bij de gezonde controlegroep dan bij de ME/cvs-patiënten.”
De groep van Iwasaki zocht ook naar ziekteverwekkers in een Zweedse ME/cvs-cohort. Ze maten de blootstelling aan virussen en bacteriën aan de hand van antilichaamrepertoires. Voor de meeste ziekteverwekkers was er echter geen verschil tussen ME/cvs-patiënten en controles wat betreft de frequentie van eerdere blootstelling.
De meest interessante studie over dit onderwerp kwam waarschijnlijk uit het laboratorium van Iwijn De Vlaminck aan de Cornell University. Zij maten RNA in het bloed van 93 ME/cvs-patiënten en 75 gezonde controlepersonen. RNA-moleculen bevinden zich normaal gesproken in cellen, maar wanneer cellen afsterven, lekt een deel ervan naar buiten. Door zich te concentreren op dit circulerende celvrije RNA in het plasma, kregen de onderzoekers van Cornell een inkijkje in wat er in verschillende cellen en weefsels gebeurt. Als er ergens in het lichaam een virus schuilgaat dat moeilijk te traceren is, zouden deze vrije RNA’s de aanwezigheid ervan kunnen onthullen. Helaas werden dergelijke aanwijzingen niet gevonden. De Vlaminck en collega’s vonden geen verschillen in virale RNA-profielen tussen ME/cvs-patiënten en controlepersonen. Ze waarschuwen echter dat ze weinig gegevens hadden over vast weefsel.
Een ouder, multicentrisch onderzoek onder leiding van Ian Lipkin vond ook “geen consistente groepsspecifieke verschillen” in virusdeeltjes in bloed, ontlasting en speeksel. Als een virus of andere ziekteverwekker ME/cvs veroorzaakt, moet deze zich wel uitzonderlijk goed kunnen verbergen.
Antilichamen
In 2025 vond ook het meest uitgebreide onderzoek naar antilichamen bij ME/cvs plaats. De groep van Maureen Hanson aan Cornell University gebruikte twee geavanceerde technieken om honderden antilichamen tegelijk te meten. De eerste was een Luminex-panel met 1134 autoantilichamen. Deze methode maakt gebruik van microscopische kralen die specifiek gekleurd zijn, zodat ze fungeren als unieke barcodes voor verschillende doelwitten. De tweede methode heet Rapid Extracellular Antigen Profiling (REAP) en werd vrij recent ontwikkeld door Aaron Ring (die ook een van de auteurs van dit artikel was). In plaats van gekleurde kralen gebruikt REAP een bibliotheek van levende gistcellen, waarbij elke cel een specifiek eiwit op zijn oppervlak vertoont met een overeenkomstige DNA-barcode in de cel. Met behulp van REAP konden de auteurs antilichamen testen tegen 6183 extracellulaire menselijke eiwitten en 225 eiwitten van menselijke virale pathogenen.
Ondanks de behoorlijke steekproefomvang werden er geen significante verschillen gevonden. Autoantilichamen tegen G-proteïne-gekoppelde receptoren (GPCR’s) zijn gerapporteerd bij ME/cvs door de groep van Carmen Scheibenbogen, maar deze bevindingen werden in dit onderzoek niet bevestigd. De auteurs concluderen: “In tegenstelling tot eerdere rapporten, toonde onze analyse van 172 deelnemers geen significante verschillen in autoantilichaamreactiviteit tussen ME/cvs-patiënten en controles, ook niet tegen GPCR’s zoals β-adrenerge receptoren.”
In de Zweedse studie van Iwasaki werd ook gezocht naar autoantilichaamreactiviteit in plasma, waarbij geen toename werd gevonden bij ME/cvs-patiënten. Voor bijna de helft van de 118 geteste antigenen was de IgM-autoantilichaamreactiviteit hoger bij gezonde personen dan bij ME/cvs-patiënten.
De antilichaamtheorie van ME/cvs lijkt net zo vast te zitten als de zoektocht naar ziekteverwekkers. De groep van Scheibenbogen vond een verhoogde aanmaak van antilichamen tegen EBV-gerelateerde antigenen, en het team van Bhupesh Prusty rapporteerde dat antilichamen van ME/cvs-patiënten mitochondriale fragmentatie in endotheelcellen veroorzaken. Beide studies zijn echter verkennend en nog niet overtuigend. Er is echter reden tot optimisme. Een behandelingsonderzoek, gericht op antilichaamproducerende cellen, is veelbelovend. We zullen deze veelbelovende pilootstudie met Daratumumab in detail bespreken in ons laatste deel over behandelingen.
Verhoogde aangeboren immuniteit
Laten we eerst verdergaan met immunologie: als het geen pathogenen of autoantilichamen zijn, wat zou het dan wel kunnen zijn? Het team van Ian Lipkin aan de Columbia University onderzoekt de aangeboren immuuncellen van ME/cvs-patiënten. Ze ontdekten dat deze cellen een sterkere cytokinerespons hebben wanneer ze worden gestimuleerd door een superantigeen.
Een superantigeen kan een groot deel van uw immuunsysteem in één keer activeren. Het is niet iets wat u in uw lichaam wil hebben omdat het een toxische shock kan veroorzaken, maar het is wel zeer geschikt om immuuncellen in het laboratorium te activeren. Lipkin en collega’s testten ook andere stimuli, zoals antigenen die een schimmelinfectie (HKCA), een bacteriële infectie (LPS) of een virale infectie (poly I:C) nabootsen. De resultaten waren als volgt: na blootstelling aan bacteriën en virussen werden geen verschillen gevonden; na blootstelling aan schimmelantigenen werden wel enkele veranderingen waargenomen, terwijl de duidelijkste veranderingen werden gevonden bij het superantigeen. De auteurs voerden deze experimenten uit vóór en na een inspanningstest om postexertionele malaise (PEM) op te wekken, maar dit had weinig invloed op het effect.
B-celrepertoire
Een studie van Audrey Ryback en Graeme Cowen bevestigde afwijkingen in B-cellen die in twee eerdere studies waren gevonden, namelijk een toename van Immunoglobuline Heavy Variable IGHV3-30.
B-cellen zijn de immuuncellen die ziekteverwekkers herkennen en gerichte antilichamen aanmaken om ze te neutraliseren. Deze antilichamen bevinden zich ook op het oppervlak van de B-cellen, waar ze als receptoren fungeren. Ons immuunsysteem creëert een bijna oneindige diversiteit aan deze receptoren, zodat het op allerlei ziekteverwekkers kan reageren. Een manier om dit te doen, is door de bouwstenen voor antilichamen in nieuwe B-cellen te selecteren en te herschikken, een beetje zoals het schudden van kaarten. IGHV3-30 is een van deze bouwstenen. Onderzoekers ontdekten dat B-cellen van ME/cvs-patiënten het vaker in hun receptoren gebruikten dan controlegroepen.
Deze verschuiving in het B-celrepertoire is normaal gesproken een teken van antilichaamproductie of een immuunreactie op een specifieke infectie. Maar in deze scenario’s zouden er ook aanwijzingen zijn dat B-cellen zichzelf kopiëren en hun antilichamen verfijnen, iets wat Ryback & Cowen niet konden vinden bij ME/cvs-patiënten. Het is daarom enigszins een raadsel wat dit betekent. Een of ander selectieproces moet deze bouwsteen hebben bevoordeeld of nuttiger hebben gemaakt voor ME/cvs-patiënten dan voor controlegroepen. Een kanttekening hierbij is echter dat de replicatiestudie alleen aantoonde dat IGHV3-30 vaker voorkomt bij patiënten met milde en matige ME/cvs, en niet bij patiënten met ernstige ME/cvs.
Plasmacytoïde dendritische cellen (pDC)
Twee studies, één van het De Vlaminck-labo en één uit Australië, vonden een verhoogd aandeel plasmacytoïde dendritische cellen (pDC) bij ME/cvs. Deze cellen produceren grote hoeveelheden type I-interferonen wanneer ze virale infecties detecteren. Omdat interferonen extreme malaise en vermoeidheid veroorzaken, zijn ze een onderwerp van bijzondere interesse in ME/cvs-onderzoek. De UK Biobank vond echter in 2019 geen toename van pDC, dus we moeten ons waarschijnlijk nog niet te veel laten meeslepen door deze bevinding.
Spieren en inspanning
Vergelijking met bedrust
Het Nederlandse onderzoeksteam onder leiding van Rob Wüst bestudeert de spieren van ME/cvs-patiënten diepgaander dan ooit tevoren. In een preprint uit 2025 vergeleken ze ME/cvs- en longcovidpatiënten met gezonde deelnemers die 60 dagen strikte bedrust ondergingen als onderdeel van een NASA-experiment. Dit stelde Wüst en zijn collega’s in staat om te onderzoeken hoe deze aandoeningen verschillen van fysieke achteruitgang.
Hoewel bedrust ernstige spieratrofie veroorzaakte, werd dit niet waargenomen bij ME/cvs of long covid. De atrofie bij de patiënten was geconcentreerd in type I-spiervezels, oftewel langzame spiervezels, die gebruikt worden voor duursporten. Bij de deelnemers die bedrust moesten houden, was de capillaire dichtheid, het aantal kleine bloedvaten per oppervlakte-eenheid spierweefsel, toegenomen, terwijl deze bij de patiënten was afgenomen. De auteurs onderzochten ook markers van mitochondriale activiteit, zoals succinaatdehydrogenase en oxidatieve fosforylatie. Deze correleerden met de VO2-max bij de deelnemers die bedrust hielden, maar niet of nauwelijks bij de patiënten. De auteurs concludeerden dat “het ontbreken van een verband tussen VO2-max en mitochondriale variabelen suggereert dat hun verminderde inspanningscapaciteit niet uitsluitend verklaard kan worden door mitochondriale ademhaling of enzymatische activiteit.” De auteurs verwachtten ook dat myoglobine, een eiwit dat zuurstof bindt, verhoogd zou zijn bij patiënten ter compensatie van een verminderde lokale zuurstofvoorziening. Myoglobine was echter alleen verhoogd bij de deelnemers die bedrust hielden, niet bij ME/cvs- of longcovidpatiënten. Het blijkt dat veel ME/cvs-patiënten niet de kenmerkende symptomen van ernstige fysieke achteruitgang vertonen.

Gebrekkig herstel
De groep van Maureen Hanson aan de Cornell University mat meer dan 6000 eiwitten voor en na twee inspanningstesten. Bloedmonsters werden verzameld op vijf verschillende tijdstippen: voor, tussen en na deze testen. Bij aanvang was er geen significant verschil in eiwitniveaus tussen patiënten en de controlegroep. De meest interessante resultaten werden niet direct na de inspanningstesten gevonden, maar na een herstelperiode van 24 uur na de eerste inspanning. Ook intrigerend: de biologische routes die verschilden van die in de controlegroep, waren vrijwel allemaal verlaagd bij ME/cvs-patiënten. Dit was bijvoorbeeld het geval voor ‘axongeleiding’, ‘T-celreceptor-signalering’ en andere immuunsignaalroutes. Wellicht wijzen deze resultaten er niet zozeer op dat er na inspanning meer spierschade optreedt, maar eerder dat het herstelmechanisme van ME/cvs-patiënten niet goed functioneert.
Binnen de spieren
Dit komt overeen met de resultaten van een Noorse studie van Karl Tronstad en collega’s. Zij testten ook duizenden eiwitten in het serum van ME/cvs-patiënten met dezelfde aptameermethode als de groep van Hanson. Aptameren zijn zeer kleine stukjes DNA of RNA die kunnen vouwen en zich binden aan een specifiek doelwit, waardoor het gemakkelijker wordt om veel eiwitten te meten. Omdat de steekproefgrootte van deze Noorse studie klein was (54 ME/cvs-patiënten), zullen we ons richten op de algemene trends. Terwijl de hoeveelheid uitgescheiden eiwitten toenam, nam de hoeveelheid intracellulaire eiwitten die vanuit de skeletspieren in het bloed werden vrijgegeven af. Deze afname houdt waarschijnlijk verband met lagere activiteitsniveaus bij ME/cvs en is moeilijk te rijmen met het idee van toegenomen spierschade.
Er was ook een studie van de Universiteit van Oxford waarbij magnetische resonantiespectroscopie (MRS) werd toegepast op de kuitspieren van 24 ME/cvs-patiënten. Deze scans stelden hen in staat om in de spieren te kijken. Ze vonden geen noemenswaardige verschillen in creatine, acetylcarnitine en lipiden, wat suggereert dat de spieren van de patiënten geen probleem hadden met het gebruik van vetzuren als energiebron.
Niets in het bloed
De afgelopen jaren zijn er verschillende rapporten verschenen over iets in het bloed van ME/cvs-patiënten dat de celfunctie verstoort. In 2025 verscheen er weer zo’n studie van Spaanse onderzoekers. Zij stelden gezonde spiercellen bloot aan serum van ME/cvs- en longcovidpatiënten en ontdekten een vermindering van de spiercontractiekracht, een verhoogd zuurstofverbruik en een upregulatie van genen die betrokken zijn bij de eiwitsynthese. De steekproefgrootte was echter vrij klein, aangezien ze slechts serum gebruikten van 4 ME/cvs-patiënten en 5 longcovidpatiënten.
Belangrijker was de studie van Audrey Ryback en collega’s. Ze herhaalden een van de eerste experimenten die wezen op iets ongewoons in het bloed van ME/cvs-patiënten. In 2016 kweekte de Noorse groep van Karl Tronstad spiercellen en stelde deze bloot aan sera van vrouwelijke ME/cvs-patiënten en gezonde controlepersonen. Ze maten de zuurstofconsumptie na toevoeging van de stressfactor oligomycine, een antibioticum dat de aanmaak van ATP remt. Aan de studie namen slechts 12 ME/cvs-patiënten deel, maar het gevonden verschil was groot. Cellen die aan patiëntenserum waren blootgesteld, vertoonden een veel hogere zuurstofconsumptie.
Ryback en collega’s herhaalden dit experiment bij 67 ME/cvs-patiënten en 53 controlepersonen, maar vonden geen effect. Dit was een correcte replicatie, aangezien we die zelden zien in het ME/cvs-onderzoeksveld. De auteurs gebruikten blindering en randomisatie, registreerden hun analyseplan vooraf en gaven een goed overzicht van mogelijke beperkingen. De belangrijkste beperkingen waren dat slechts een paar van hun patiënten ernstige ME/cvs hadden en dat de deelnemers mogelijk geen postexertionele malaise (PEM) ervoeren op de dag van de monstername.
Autopsies en de stressreactie
Er waren in 2025 nog niet veel studies met hersenscans, maar er was wel een fascinerend rapport over zeven autopsies van ME/cvs-patiënten die in Nederland waren uitgevoerd. Deze informatie werd gedeeld tijdens een presentatie op de IACFS/ME-conferentie, maar de resultaten zijn nog niet gepubliceerd.
Normaal gesproken zouden we ons niet zozeer richten op zulke voorlopige bevindingen, maar aangezien er zelden autopsies worden uitgevoerd bij ME/cvs-patiënten en genetische gegevens wijzen op een hersenafwijking, kunnen deze bevindingen van groot belang zijn. De onderzoekers van de Nederlandse Hersenbank (NBB) lijken bovendien iets opmerkelijks te hebben ontdekt. Ze ontdekten dat de overleden ME/cvs-patiënten vrijwel geen CRH-producerende neuronen hadden. Andere neuronen in de hypothalamus waren niet aangetast. CRH, oftewel ‘corticotropin-releasing hormone’, speelt een belangrijke rol bij het opwekken van een stressreactie en de productie van cortisol.
Iets soortgelijks werd gerapporteerd bij narcolepsie type I. Dit is een zeldzame auto-immuunziekte die de neuronen aantast die orexine produceren en de slaap reguleren. Door een tekort aan orexine vallen patiënten overdag oncontroleerbaar in slaap en lijden ze aan plotselinge spierzwakte. In 2021 voerden onderzoekers autopsies uit op vijf narcolepsiepatiënten en vonden een afname van 88% in CRH-producerende neuronen. Dit is zeer vergelijkbaar met wat is gerapporteerd voor ME/cvs.
Het lijkt echter onwaarschijnlijk dat het immuunsysteem zowel orexine- als CRH-neuronen zou aanvallen. Vervolgonderzoek suggereerde een andere verklaring: de CRH-neuronen bestaan waarschijnlijk nog steeds, maar zijn epigenetisch geherprogrammeerd om geen CRH meer te produceren. Onderzoekers detecteren deze neuronen met behulp van antilichamen die zich binden aan CRH. Als de cellen epigenetisch zijn “uitgeschakeld” en het hormoon niet meer produceren, lijkt het alsof ze er niet meer zijn.
We vermoeden dat iets soortgelijks is gebeurd in de hersenen van ME/cvs-patiënten die zijn onderzocht in de Nederlandse Hersenbank. ME/cvs omvat geen auto-immuunreactie tegen orexineneuronen, maar misschien heeft een ander proces hetzelfde neveneffect: het uitschakelen van de CRH-neuronen. We denken aan een mogelijke bijwerking omdat de rapporten over een verlaagd cortisolgehalte bij ME/cvs inconsistent zijn en er weinig bewijs is voor een verstoorde stressreactie. Gelukkig ontvingen de onderzoekers van de Nederlandse Hersenbank vier jaar lang financiering van het Nederlandse ME/cvs-programma om hersenen te bewaren en autopsies uit te voeren. Hopelijk weten we dus vrij snel wat de bevindingen betekenen.
Een studie uit 2025 sloot mooi aan bij de autopsieresultaten. Het onderzoeksteam onder leiding van Chris Armstrong bestudeerde 135 metabole markers, zoals lipiden en vetzuurverhoudingen, met behulp van de UK Biobank. Ze analyseerden afzonderlijk welke genen geassocieerd zijn met deze metabolieten bij ME/cvs-patiënten en controlegroepen. Bij een vergelijking van de genassociaties in beide groepen bleken er echter vier significant geassocieerd te zijn met metabole markers, maar alleen in de ME/cvs-groep. Dit waren SCGN, dat een belangrijke rol speelt bij de afgifte van het stresshormoon CRH, en HSD11B1, dat cortisone omzet in het stresshormoon cortisol.
Economische last
Enkele studies uit 2025 gaven ons meer inzicht in de epidemiologie en de impact van ME/cvs. De RECOVER-studie rapporteerde bijvoorbeeld dat volwassenen die besmet zijn met SARS-CoV-2 ongeveer vijf keer zoveel kans hebben om ME/cvs te ontwikkelen. Helaas beoordeelde RECOVER ME/cvs met (problematische) vragenlijsten in plaats van een klinisch onderzoek. Dat zou kunnen verklaren waarom het aantal incidenten veel hoger lag dan eerdere schattingen.
In Duitsland schatte een rapport van Risklayer en de ME/CFS Research Foundation de economische kosten van ME/cvs op ongeveer 30 miljard euro, of 0,7% van het bbp. Dit is waarschijnlijk de meest accurate schatting van de economische impact van ME/cvs tot nu toe. Uit een Noorse studie bleek dat ME/cvs ook de gezondheidsproblemen bij mantelzorgers verergerde en traditionele genderrollen versterkte: vrouwelijke mantelzorgers werkten minder en mannelijke mantelzorgers meer.
De MCAM-studie in de VS vond hoge percentages orthostatische symptomen in de cohort van 301 ME/cvs-patiënten. In een eerder artikel bekritiseerden we de specificiteit van de kanteltafeltest voor het meten van orthostatische tachycardie. In deze MCAM-studie werd echter een eenvoudigere kanteltafeltest gebruikt, die minder snel tot overdiagnose leidt. Ongeveer 10% van de patiënten had posturale orthostatische tachycardie, vergeleken met circa 5% in de controlegroep. Voor orthostatische hypotensie waren de percentages respectievelijk 6% en 3%.
Het team van Leonard Jason uit Chicago ontwikkelde een korte vragenlijst met 10 items om PEM te beoordelen: de DSQ-PEM-2. Deze bevat extra vragen over PEM-triggers, een vertraagd begin en een langdurig herstel, en werd getest bij een grote groep van 1534 ME/cvs-patiënten. Patiënten meldden echter ook enkele problemen. Verschillende vragen richten zich op alledaagse vermoeidheid na inspanning (in plaats van op PEM), en veel van de genoemde triggers, zoals voedingsmiddelen, schimmels en chemicaliën, houden niet direct verband met inspanning.
Behandelingen
In 2025 werden er behandelingsonderzoeken uitgevoerd met rapamycin, infusen met zoutoplossing, Mestinon, magnetische stimulatie en hyperbare zuurstoftherapie. Al deze studies misten echter een controlegroep.
De studie die de meeste opwinding veroorzaakte, was de pilootstudie met daratumumab. Deze studie werd uitgevoerd door de Noorse oncologen Fluge en Mella, die enkele jaren eerder ook de rituximab-studie hadden uitgevoerd. Zij vermoeden dat antilichamen een rol spelen in de pathologie van ME/cvs. Ze testten rituximab omdat dit middel zich richt op het CD20-eiwit op het oppervlak van B-cellen, immuuncellen die veel antilichamen produceren. Helaas bleek deze hypothese niet te kloppen, zoals de fase III-studie met rituximab aantoonde; patiënten die het medicijn kregen, presteerden niet beter dan de controlegroep.
Er bestaat echter een groep langlevende en volwassen B-cellen die veel antilichamen produceren, maar het CD20-eiwit niet tot expressie brengen. Dit worden plasmacellen genoemd. Ze bevinden zich in het beenmerg of de darmen en zouden een kortdurende behandeling met rituximab kunnen hebben overleefd. In plaats van CD20 brengen ze het CD38-eiwit tot expressie op hun oppervlak. Door daratumumab te gebruiken, dat zich richt op CD38, hopen Fluge en Mella deze plasmacellen te doden en de productie van autoantilichamen te stoppen.
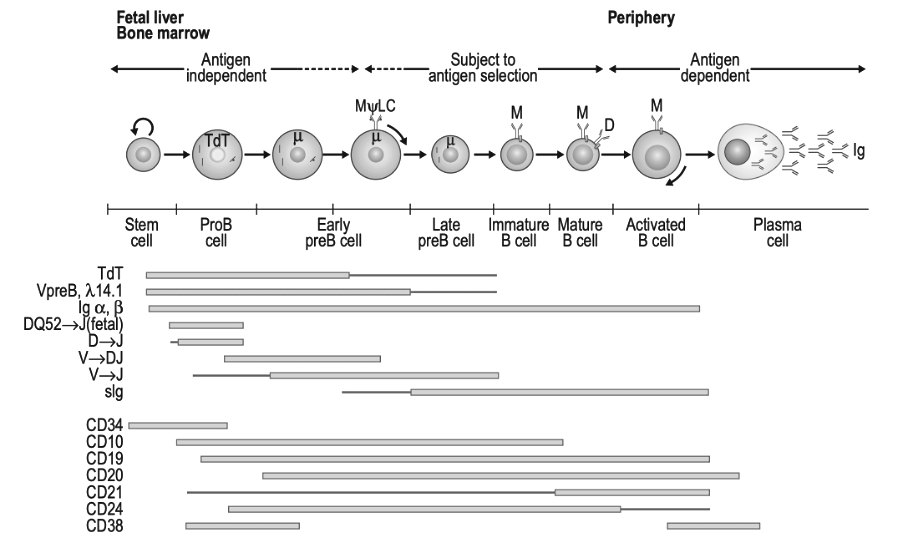
Figuur 7.1 ‘Model van B-celdifferentiatie’ uit het boek ‘Clinical Immunology Principles and Practice, Fifth Edition’. Omgezet naar zwart-wit.
Hun pilootstudie met tien vrouwelijke ME/cvs-patiënten ziet er veelbelovend uit. Vier patiënten vertoonden geen significante klinische veranderingen, maar de verbeteringen bij de andere patiënten waren aanzienlijk. De resultaten met betrekking tot het aantal stappen en het fysieke functioneren suggereren dat sommige patiënten bijna op een normaal niveau zaten. Ook interessant: het aantal NK-cellen was bij alle deelnemers vrij laag, maar bij degenen met een hoger aantal was de respons op de behandeling beter. Fluge en Mella zijn een gerandomiseerde studie met daratumumab gestart, genaamd RESETME, dus we weten mogelijk relatief snel of deze behandeling werkt (u kunt hun studie hier steunen).
In de komende jaren zullen we waarschijnlijk een antwoord krijgen op een veelgestelde vraag: wordt ME/cvs veroorzaakt door antilichamen? Rituximab, dat zich richt op de meeste B-cellen, is al getest. Zowel de Noorse groep als de Scheibenbogen-groep zijn van plan om geneesmiddelen te testen die zich richten op CD38 en plasmacellen. Er lopen ook placebogecontroleerde studies naar immunoadsorptie, waarbij antilichamen uit het bloed worden gefilterd. En, belangrijk, de resultaten van de DecodeME-studie naar het HLA-gebied zullen worden gepubliceerd. Dit genetische gebied helpt het immuunsysteem om eigen cellen te onderscheiden van indringers van buitenaf. Vrijwel alle auto-immuunziekten – multiple sclerose, spondylitis ankylosa, diabetes type 1, psoriasis, de ziekte van Hashimoto, enz. – vertonen een verband met HLA-varianten. Als al deze experimenten negatieve resultaten laten zien, zou de antilichaamtheorie een flinke klap krijgen en onwaarschijnlijk worden. Als een van deze onderzoeken echter wel een effect aantoont, zou dat weer een belangrijk stukje van de puzzel zijn. Een echte doorbraak.
Gelukkig Nieuwjaar
Hartelijk dank aan iedereen op het Science for ME-forum voor hun inzichten en discussies. Deze helpen ons enorm bij het begrijpen van complexe onderzoeksartikelen.
Als je denkt dat we een belangrijk ME/cvs-onderzoek in 2025 hebben gemist, laat het ME/CFS Science dan gerust weten in de reacties onder het artikel.
Fijne feestdagen en een prachtig 2026 gewenst!
© ME/CFS Science, 30 december 2025.





