Cort Johnson, Health Rising, 26 april 2020

Het nieuwste werk van Prusty met betrekking tot HHV-6 werd ondersteund door het Solve ME/CFS Initiative en de HHV-6 Foundation.
Onverwachte synchrone gebeurtenissen zijn altijd een goed teken. Velen zijn natuurlijk bekend met Dr. Bob Naviaux, PhD, van de University of California in San Diego (UCSD). Het metabolomicawerk van Naviaux en zijn hypothese over de celgevaarreactie (CGR) hebben nieuwe mogelijke manieren geopend om ME/cvs en andere ziekten te begrijpen.
Naviaux is het meest bekend door zijn metabolomische werk, maar wat de meeste mensen niet weten is dat Naviaux ook een aan het Salk Institute opgeleide viroloog is, die retrovirale genoverdrachtsvectoren uitvond, en is bovendien ook nog opgeleid in naturalkillercelbiologie – een belangrijk onderwerp bij ME/cvs.
Bhupesh Prusty, PhD, van Universität Würzburg in Duitsland, is nieuwer in het veld, maar heeft al wenkbrauwen doen fronsen met zijn stelling dat herpesvirussen zoals HHV-6 (en ook andere virussen) de mitochondriën bij ME/cvs-patiënten helemaal in de war zouden sturen.
De twee auteurs – Prusty en Naviaux – waren de co-seniorauteurs die het project bedachten – en vormden een team om te proberen een vraag te beantwoorden die patiënten, dokters en onderzoekers jarenlang heeft geplaagd: hoe de energieproblemen bij ME/cvs in verband gebracht konden worden met het infectueuze begin van de ziekte dat door zoveel patiënten wordt ervaren. Vanuit twee verschillende werkvelden hebben Bhupesh Prusty en Bob Naviaux mogelijk een manier bedacht. Zij kozen, hoe kan het ook anders, herpesvirussen (HHV-6, HHV-7) om hun hypothese te testen.

Bob Naviaux’ celgevaarreactiehypothese opende nieuwe mogelijke manieren om ME/cvs te begrijpen.
Herpesvirussen uit een grote en diverse groep, Epstein-Barrvirus (EBV), Cytomegalovirus (CMV) en Herpessimplexvirussen (HSV-1 en 2) hebben het vermogen om latent aanwezig te blijven in het lichaam en dan te exploderen in activiteit tijdens periodes van stress of immuundeficiëntie. Dat heeft hen altijd tot een duidelijk doelwit gemaakt in een ziekte die grotendeels wordt gedefinieerd door symptomen die verband houden met infecties.
Bij de humane herpesvirussen (HHV-6 en 7) ligt het een beetje anders. Meer dan 90% van de mensen is geïnfecteerd tegen de leeftijd van drie jaar, meestal door het speeksel van hun moeder. Het virus laat dan een kopie van zijn DNA achter in een chromosoom van een paar cellen, en wordt dan sluimerend. Voor de meeste mensen geldt dat we nooit weten of HHV-6 gereactiveerd is of niet.
Prusty en Naviaux denken dat dit komt omdat, wanneer HHV-6 opnieuw geactiveerd wordt, het cellen uitlokt om een beschermende factor te produceren die andere cellen helpt te voorkomen dat zij geïnfecteerd raken (supergeïnfecteerd) met andere virussen. Dit beschermingsmechanisme heeft echter nadelige gevolgen: mitochondriale fragmentatie en een afname van energieproductie in de cellen.
Bij mensen die geen ME/cvs hebben, is dit een normaal fenomeen en duurt dit slechts een paar dagen aan het begin van een nieuwe infectie of na blootstelling aan bepaalde chemische stoffen uit de omgeving, of na fysieke verwondingen. Bij ME/cvs denken zij echter dat cellen die geïnfecteerd zijn met HHV-6, verder gaan met het afscheiden van een substantie die de energieproductie in de cellen afremt, wat leidt tot vermoeidheid, en alle andere symptomen van de ziekte.
De zeer lage virale ladingen [n.v.d.r.: hoeveelheden van het virus in een bepaalde hoeveelheid lichaamsvloeistof, meestal bloedserum] van HHV-6 die in eerdere ME/cvs-studies werden aangetroffen, hebben gesuggereerd dat actieve herinfectie met het virus geen probleem is. Een studie uit 2019 naar HHV-6-antilichamen, die voornamelijk subtiele problemen aan het licht bracht, zorgde ook niet voor meer belangstelling. (Merk daarbij op dat die studie zich grotendeels richtte op late antilichamen, hetgeen de sluimerende infectie zou missen, waarvan sommigen denken dat deze gaande is). Bovendien lijden alle serologische studies naar HHV-6 tot nu toe aan het onvermogen om verschil aan te brengen tussen de moeilijker te onderzoeken, en mogelijk gevaarlijkere, HHV-6a en HHV-6b.
In 2018 produceerde Prusty echter een controversiële paper die de HHV-6-onderzoekswereld in beroering bracht. Zijn cellijnstudie suggereerde dat hij hele kleine niet-coderende RNA’s (sncRNA) had geïdentificeerd die door het virus in de vroegste stadia van reactivatie werden geproduceerd, maar voordat enige virusreplicatie plaatsvond. De productie van deze sncRNA produceerde een signaal dat de mitochondriale activiteit in de geïnfecteerde cellen veranderde en de mitochondriën deed fragmenteren. De studie suggereerde dat HHV-6 mogelijk de energiemotoren van de cellen uitzette zelfs terwijl het grotendeels rustig in de cel verbleef. Het was alsof het virus de cellen in stasis bracht.
Als Prusty gelijk had, kon je de data m.b.t. virale lading bij ME/cvs wel meteen vergeten: HHV-6 hoefde zich niet te vermenigvuldigen om zoiets als ME/cvs veroorzaken – het hoefde alleen maar een beetje actief te zijn.
Niemand in het HHV-6-werkveld was daarvoor op dat idee gekomen, maar Bob Naviaux in San Diego had een vergelijkbaar paradigma ontwikkeld dat stelde dat de cellen van ME/cvs-patiënten op infecties en andere stressoren hadden gereageerd door vast te komen zitten in een hypometabole toestand (d.w.z. een toestand van winterslaap of dauer, het Duitse woord voor iets wat blijft aanhouden).
Het kernprobleem van ME/CVS geïdentificeerd? Naviauxs studie naar het metaboloom opent een nieuwe deur
“Dit werk opent een nieuwe deur naar zowel het begrijpen van de biologie van CVS en, belangrijker voor de patiënten, een robuuste, rationele manier om nieuwe behandelingen te ontwikkelen voor een ziekte die daar grote nood aan heeft” Robert Naviaux De Dafoes keken naar elkaar in verbazing.
Naviaux stelde dat de getroffen cellen gebruikt maakten van iets wat hij “celgevaarreactie” noemde, om hun motoren uit te zetten en alle energie opnieuw om te leiden naar de cellulaire verdediging en overleving, wat echter ten koste gaat van voldoende energie voor normale cellulaire activiteit en functie.
Het metabole systeem, in het bijzonder de mitochondriën, dacht hij, werkten hand in hand om indringers tegen te houden. In feite was het, in het paradigma van Naviaux, het metabole of energieproducerende systeem dat bij het immuunsysteem alarm sloeg en niet andersom.
Een artikel in Nature uit 2015, dat meer dan 500 keer is geciteerd, was het hiermee eens. De studie vond dat er slechts matige mitochondriale stress nodig was om de antivirale verdediging van de cel enorm op te drijven. Het suggereerde dat het het eerste doel van een pathogeen was om de mitochondriën te beschadigen, uit te zetten of te ontwrichten van de cel die het infecteerde. Van zodra de tekenen van mitochondriale schade zich echter voordeden – nu wetende dat er een ziekteverwekker aanwezig was – zette de cel zijn antivirale batterijen aan.
Pas afgelopen jaar toonde een Frans team aan dat bacteriën proberen om de machines die de immuuncellen energie leveren, ook uit te zetten. De cellulaire immuniteitsverdediging lijkt te beginnen bij de mitochondriën.
De studie
Philipp Schreiner, Thomas Harrer, Carmen Scheibenbogen, Stephanie Lamer, Andreas Schlosser, Robert K Naviaux, Bhupesh K Prusty Human Herpesvirus-6 Reactivation, Mitochondrial Fragmentation, and the Coordination of Antiviral and Metabolic Phenotypes in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Immunohorizons. 2020 Apr 23;4(4):201-215. doi: 10.4049/immunohorizons.2000006.
Om zich ervan te verzekeren dat replicatie geen factor was, kozen de auteurs een cellijn (U2-OS) die de CD46-receptor heeft die HHV-6 in staat stelt om de cel binnen te komen en te integreren in het DNA, maar die het virus niet in staat stelt om zijn levenscyclus te voltooien. Dit stelde de onderzoekers in staat om zich te richten op de zeer vroege stadia van reactivatie.
HHV-6 was het virus dat werd bestudeerd, maar de auteurs denken dat andere virussen waarschijnlijk hetzelfde effect hebben
Deze cellen met een latente chromosomale geïntegreerde kopie van HHV-6 DNA worden ciHHV-6-U2-OS-cellen genoemd. Eerder bewijs suggereerde dat in een vroeg proces dat transactivatie wordt genoemd (in tegenstelling tot replicatie), HHV-6 begon met het treffen van voorbereidingen voor zijn volgende aanval door het afgeven van kleine RNA’s die bedoeld waren om de mitochondriën van de cellen te verstoren.
Prusty en Naviaux behandelden eerst de cellen die een latente kopie van HHV-6 bevatten met een chemisch middel dat TSA wordt genoemd en dat cellulaire stress veroorzaakt, en onderzochten daarna veranderingen in de mitochondriën van de cellen en hun eiwitproductie. Zij vonden dat terwijl de cellen met HHV-6 de kleine RNA’s begonnen te produceren, de mitochondriën in de cellen begonnen te fragmenteren. Veranderde niveaus van verschillende belangrijke mitochondriale eiwitten die betrokken zijn bij het cellulair metabolisme (glycolyse, foliumzuurmetabolisme, vetzuuroxidatie, etc.) suggereerden dat de RNA’s niet alleen een impact hadden op het metabolisme van de mitochondriën maar ook op dat van de cellen.
De kern van het verhaal
- Terwijl de lage virale ladingen van HHV-6 suggereerden dat deze niet betrokken was bij ME/cvs, suggereerden een paar onderzoekers dat een smeulende infectie aanwezig kan zijn
- Bhupesh Prusty heeft bewijs geleverd dat een laaggradige smeulende infectie inderdaad aanwezig zou kunnen zijn in een subgroep van ME/cvs-patiënten
- Prusty denkt dat heel vroeg in de reactivatiefase van HHV-6, HHV-6 probeert om de mitochondriale output van de cel te verminken door kleine niet-coderende RNA’s te produceren die mitochondriale fragmentatie en metabolisch verval veroorzaken.
- In reactie op de mitochondriale schade die de geïnfecteerde cel opmerkt, voert de cel zijn antivirale verdediging op, en deze, volgens Bob Naviaux, in een hypometabolische toestand brengt – waarbij de meeste energie van de cel naar de verdediging tegen virussen gaat – wat weinig energie overlaat voor iets anders.
- De geïnfecteerde cellen lijken ook iets af te scheiden dat andere cellen om hen heen in een vergelijkbare “celgevaarreactie” brengt. Dit is een belangrijke stap omdat weinig cellen direct geïnfecteerd lijken te zijn.
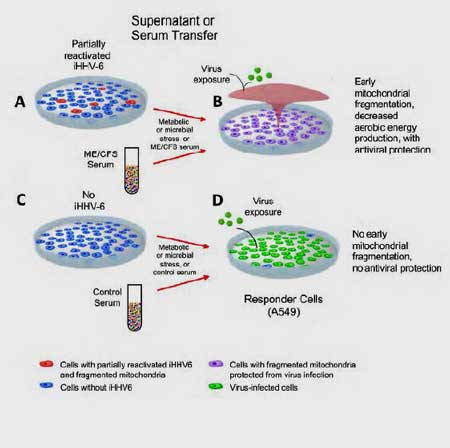
- De verrassing kwam toen Prusty en Naviaux aantoonden dat hetzelfde proces plaatsvond als serum uit de cellen van ME/cvs-patiënten werd toegevoegd aan gezonde, niet-geïnfecteerde cellen; mitochondriën begonnen te fragmenteren en de eerder gezonde cellen ontwikkelden een sterke antivirale reactie.
- De studie van Prusty en Naviaux kan helpen de bevindingen van 2016 te verklaren die suggereren dat het samenvoegen van cellen van ME/cvs-patiënten met gezonde cellen ervoor zorgt dat de energieproductie of andere factoren in de gezonde cellen doet verminderen.
- Zij denken ook dat de celgevaartoestand waarin de cellen van ME/cvs-patiënten verkeren, zou kunnen verklaren waarom sommige ME/cvs-patiënten zelden verkoudheden krijgen.
- Zij proberen nog steeds om de aard te bepalen van de mysterieuze substantie die andere cellen mogelijk zeer waakzaam maakt en hun energieproductie vermindert.
- Naviaux en Prusty onderzoeken ook manieren om het signaal te blokkeren waarvan zij denken dat het niet-geïnfecteerde cellen in de “celgevaarmodus” brengt.
- Gezien het innovatieve van hun onderzoek, was het geen verrassing dat dit ondersteund werd door particuliere stichtingen zoals het Solve ME/CFS Initiative en de HHV-6 Foundation. Particuliere donaties spelen een centrale rol In het ondersteunen van onderzoekers die een creatieve benadering hebben van ME/cvs.
De downregulatie van een erbij betrokken eiwit dat pyruvaatdehydrogenase heet – een belangrijk enzym bij het reguleren van glycolyse – was van buitengewoon belang, omdat geïnfecteerde immuuncellen hun energie moeten verkrijgen uit glycolyse (ATP-productie die geen zuurstof verbruikt), in plaats van mitochondriale oxidatieve fosforylering (ATP-productie die zuurstof verbruikt). (Verscheidene studies suggereren dat problemen met pyruvaatdehydrogenase ten grondslag kunnen liggen aan de energiedisfunctieproblemen bij ME/cvs). De afname van een antioxidant – superoxidedismutase – stemde vergelijkbaar overeen met toegenomen oxidatieve stress bij ME/CVS – iets waarvan we ook weten dat het voorkomt.
(In een paper uit 2012 “Oxidatieve Afscherming of Oxidatieve Stress?” zette Bob Naviaux de onderzoekswereld rond oxidatieve biologie op zijn kop toen hij stelde dat hoge niveaus van oxidatieve stress niet het gevolg waren van een storing in het antioxidantensysteem, maar een doelgerichte en beschermende reactie waren die evolutionair bewaard was gebleven in alle planten en dieren. In 2016 stelde Naviaux dat cellen die worden bedreigd “gevaarsignalen” produceren zoals ATP en ADP, intermediairen van de krebscyclus, zuurstof en reactieve zuurstofsoorten (ROS) die bij andere cellen in gevaar alarm slaan.
Omdat zij constateerden dat mitochondriale fragmentatie, niet verrassend, de ATP-productie van een cel vermindert, deden zij metingen bij de ATP-productie en mitochondriale fragmentatie van cellen met en zonder HHV-6-infecties.
Toen ze verminderde niveaus aantroffen van ATP en verhoogde niveaus van mitochondriale fragmentatie bij de HHV-6 gereactiveerde cellen, concludeerden zij dat HHV-6 niet hoeft te repliceren om de energieproductie van een cel af te remmen.
Toen werd het ECHT interessant. Zij voegden de voedingsbodem van cellen met vroege HHV-6-reactivatie toe aan afzonderlijke kweken van naïeve cellen om te zien of iets dat door de geïnfecteerde cellen werd afgescheiden, de immuunverdediging zou doen toenemen bij niet-geïnfecteerde of naïeve cellen.
De naïeve cellen werden daarna getest op hun vermogen om een infectie af te weren met RNA- en DNA-virussen zoals het Influenza A-virus en Herpessimplexvirus 1 (HSV-1). De onderzoekers ontdekten dat zo gauw de naïeve cellen behandeld waren met de voedingsbodem uit de geïnfecteerde cellen, zij ook in staat waren om de infecties af te weren waaraan zij werden blootgesteld.
Het verband met ME/cvs
Vervolgens verschenen de ME/cvs-stalen voor de eerste keer op het strijdtoneel. Ze herhaalden vervolgens hetzelfde experiment, maar in plaats van gebruik te maken van een voedingsbodem, stelden ze de naïeve cellen bloot aan serum van 10 ME/cvs-patiënten.
Het serum van ME/cvs-patiënten beschermde naïeve cellen in het laboratoriumschaaltje, maar het serum van gezonde controles deed dit niet. Iets in het serum van de ME/cvs-patiënten leek het griepvirus en HSV-1 onder handen te hebben genomen en ze te hebben uitgeroeid voordat ze de cellen die eraan waren blootgesteld, konden infecteren.
Toen de naïeve cellen echter werden behandeld met het serum van gezonde controles, werden de cellen niet beschermd en gingen ze dood.
Dat is de. fascinerende bevinding gezien de rapporteringen van Ron Davis en de bevinding van Oystein Fluge uit 2016, die suggereerden dat het inbrengen van gezonde cellen in het serum van ME/cvs-patiënten hun energieproductie stopzet. Zou een licht smeulende HHV-6-infectie de schuldige kunnen zijn? Dat suggereerde dat de verdediging tegen virussen bij ME/cvs inderdaad in hoogste staat van paraatheid was – en zou kunnen verklaren waarom sommigen met ME/cvsslechts zelden verkoudheden krijgen. Naviaux schreef in een persbericht:
“Dit verklaart de algemene waarneming dat ME/cvs-patiënten vaak een scherpe afname melden in het aantal verkoudheden en virale infecties die ze ervaren nadat ze de ziekte ontwikkelden. Ons werk helpt ook bij het begrijpen van het lang gekende, maar slecht begrepen verband tussen ME/cvs en eerdere infecties met humaan herpesvirus-6 (HHV-6) of HHV-7.”
Maar wat voor soort antiviraal kryptoniet produceerden de ME/cvs-cellen? De meest waarschijnlijke gok was dat de cellen hun belangrijkste intracellulaire virusbestrijder, interferon, uitpompte, maar verrassend genoeg was de activiteit van het interferon verminderd en niet toegenomen, evenals een belangrijke pro-inflammatoire virusbestrijder tumornecrosefactor-alfa (TNF-a).
De identiteit van de immuniteit verbeterende/energieuitputtende mysterieuze substantie in het serum van de ME/cvs-patiënten zal nu nog een mysterie blijven, maar de auteurs suggereerden dat andere cytokines, of het NLPR3-inflammasoom, of zelfs de aanwezigheid van autoantilichamen, een sterke pro-inflammatoire toestand zou kunnen veroorzaken die het moeilijk maakt voor intracellulaire virussen om te floreren. (Onlangs publiceerde één van de coauteurs van deze paper, Carmen Scheibenbogen, een aparte studie die aantoonde dat een aanzienlijke subgroep ME/cvs-patiënten toegenomen niveaus heeft van adrenerge autoantilichamen.
Naviaux stelde dat een tweesnijdend zwaard de schuldige is van de symptomen bij ME/cvs. Aan de ene kant scheiden veel van hun cellen een signaal af dat andere cellen beschermt voor superinfectie met vele (RNA- en DNA-)virussen. Aan de andere kant gaat dit ten koste van het ontwrichten van normale mitochondriale vorm en functie, wat leidt tot uitputting van de energiereserves, en vatbaarheid voor crashes bij ofwel fysieke ofwel mentale inspanning. Doordat het meeste van de energie van de cel wordt gebruikt voor intracellulaire afweer, is er niet veel over voor het normale functioneren van de cellen – vandaar de vermoeidheid en wijdverspreide problemen bij ME/cvs.
Conclusie
Zou het een heel licht smeulende HHV-6- of HHV-7-infectie kunnen zijn die het vermogen vernietigt van de niet-geïnfecteerde cellen bij ME/cvs om energie te produceren? En hen tegelijkertijd om te vormen tot antivirale duracellkonijnen?
De nieuwheid van die ideeën zou kunnen zijn waarom de Schriener/Prusty-paper uiteindelijk werd gepubliceerd in een immunologievakblad in plaats van in een virologievakblad. Voor nu lijkt de HHV-6-gemeenschap een afwachtende houding aan te nemen met betrekking tot het idee dat een herpesvirus, dat grotendeels rustig in een cel verblijft – en ook niet in heel veel cellen – zo’n effect zou kunnen hebben.

Twee nieuwe hypothesen ontmoeten elkaar in één studie. De tijd zal uitwijzen of Prusty en Naviaux gelijk hebben.
De bevindingen zijn in lijn met de CGR-hypothese (“celgevaarreactie”) van Naviaux, die stelt dat mitochondriale verstoringen een proces in stand houden dat er voor zorgt dat de cel zich vastzet en in een hypometabole toestand terechtkomt als een beschermende reactie op stress. Deze studie is ook de eerste die potentieel de waarnemingen verklaart van Ron Davis en Oystein Fluge van vier jaar geleden dat iets in het serum van ME/cvs-patiënten de gezonde cellen in een toestand van ogenschijnlijke winterslaap stuurt.
Gezien het kleine formaat van de studie moeten er veel grotere studies worden gedaan om deze resultaten te valideren en blijven er veel vragen. Als reactivatie of een slapende kopie van HHV-6-DNA in slechts een paar cellen genoeg is om een signaal af te scheiden dat andere cellen in slaap kan brengen, waarom gebeurt dat bij mensen met ME/cvs en niet bij anderen? Als HHV-6b vaak wordt opgelopen als kind, waarom kont ME/cvs dan met name naar voren in de adolescentie en volwassenheid? Zou het moeilijk te diagnosticeren HHV-6a de schuldige zijn? Of zou deze vreemde immuun-metabole ontsporing plaatsvinden bij elk virus – zoals de auteurs suggereren? Naviaux suggereert dat een veranderde cellulaire of genetische factor ME/cvs-patiënten zeer kwetsbaar kan maken voor het terechtkomen in een meer of minder permanente celgevaarreactie (CGR).
Naviaux en Prusty vatten de hoogtepunten van hun paper samen in de twee belangrijkste boodschappen. De paper stelt dat er sprake is van:
- een mogelijk universeel mechanisme dat ook kan worden gebruikt door HHV-6, HHV-7 en andere virussen.
- de ontdekking van een gastcelsignaal en factoren die ervoor kunnen zorgen dat de CGR voortduurt bij ME/cvs-patiënten, maar normaal gesproken wordt gestopt nadat het gevaar geweken is bij de normale populatie.
Naviaux en Prusty rapporteerden dat zij de mysterieuze substantie “op de hielen zitten” waarvan zij geloven dat deze een chronische celgevaarreactie bij ME/cvs veroorzaakt. Zij testen ook suramine en verschillende andere potentiele behandelingen in het laboratorium om te zien of zij het signaal uit kunnen zetten of blokkeren. Dit succesvol doen in het laboratorium zou de weg kunnen banen voor mogelijke klinische studies in de toekomst.
Onderzoek naar virussen is aan het veranderen. Prusty en Naviaux staan niet alleen in het suggereren dat virussen het lichaam op verrassende manieren kunnen beschadigen. Marshall Williams aan de Ohio State University heeft steeds een hypothese nagejaagd dat smeulende en niet-replicerende Epstein-Barrvirusinfecties ook eiwitten produceren die vermoeidheid en andere symptomen veroorzaken bij een subgroep ME/cvs-patiënten.
Er moet worden opgemerkt dat de subsidie voor deze nieuwe studie niet van de NIH kwam, maar van particuliere stichtingen zoals het Solve ME/CFS Initiative, de HHV-6 Foundation, de Khosla Foundation en anderen. Dat is niet verrassend voor dit werkveld.
Van de nanonaald van Ron Davis tot de hypothese van de metabole valkuil van Robert Phair, tot het nieuwe medicijn van Cortene, tot de tweedaagse inspanningsstudies van Workwell, Gordon Brodericks en Travis Traddocks inspanningen om tot een model te komen, naar het werk rond EBV van Marshall Williams en de celgevaarreactiehypothese van Naviaux, het werk rond HHV-6 van Bhupesh Prusty, het vakgebied rond ME/cvs is gevuld met creatieve onderzoekers die tegen lang bestaande normen aanbeuken.
Dat kan het soms moeilijk maken om subsidie te krijgen van instituten zoals de NIH. In feite heeft directeur van het NINDS, Walter Koroshetz, gesuggereerd dat het antwoord op ME/cvs niet zal komen vanuit de NIH. (Als het gebeurt zal de NIH het steunen, maar hij gelooft niet dat het antwoord van binnen de muren van de NIH zal komen,) Dat maakt het nog belangrijker om deze creatieve en vitale onderzoeksinspanningen levend te houden.
© Health Rising. Vertaling Meintje, redactie Zuiderzon en Abby, ME-gids.
Lees ook





