Cort Johnson, Health Rising, 24 juli 2019
Dit is het derde van een reeks berichten over het niet-thyroïdaal ziektesyndroom, NTIS – een bepaalde verandering in schildklierhormoonactiviteit die vaak optreedt bij zeer zwaar letsel en levensbedreigende ziekten. Een recente studie suggereert dat NTIS ook aanwezig kan zijn bij ME/cvs (Ruiz-Núñez et al., 2018). Dominic levert meer aanwijzingen voor een mogelijk verband tussen de twee syndromen door te laten zien dat twee factoren die volgens studies een rol spelen bij ME/cvs (oxidatieve stress en cytokines), ook verantwoordelijk blijken te zijn voor het in stand houden van langdurige of chronische NTIS. De behandelingen die uitgetest zijn bij ME/cvs en langdurige NTIS, zijn ook vergelijkbaar.
Let op! Dit is een lange en technische post – misschien kan je een afdruk maken.
Samenvatting
Onderzoekers spreken van een “vicieuze cirkel” van cytokines, oxidatieve stress en een verminderde activiteit van schildklierhormonen om het chronische “niet-thyroïdaal ziektesyndroom” (NTIS) te verklaren: een aandoening die zich kan voordoen in reactie op vrijwel elke vorm van ernstige infectie, zwaar letsel, ziekte of chirurgische stress.
Soortgelijke patronen, waargenomen bij ME/cvs, suggereren dat vijf decennia aan onderzoek naar NTIS misschien ook ons inzicht kunnen vergroten van de mechanismen die ten grondslag liggen aan ME/cvs.
Bovendien zijn de behandelingen die voor NTIS zijn getest, ook vergelijkbaar met wat door sommige ME/cvs-behandelaars wordt voorgesteld. Ze bestaan uit suppletie met schildklierhormonen, toediening van hormonen die door de hypothalamus worden afgescheiden, suppletie met antioxidanten en modulering van het immuunsysteem.
Inleiding
Toen ik onderzoek deed naar wat de slopende aandoening van mijn vrouw zou kunnen verbeteren, ontdekte ik dat de meeste ME/cvs-artsen het immuunsysteem behandelen, dat sommigen onder hen de werking van schildklierhormonen aanpakken, en dat er een paar artsen zijn die zich zowel op het immuunsysteem als op schildklierhormonen richten (zie mijn vorige blogpost). Dr. Sarah Myhill, bijvoorbeeld, gelooft dat voornamelijk immunologische problemen de basis vormen voor ME/cvs, maar ze beschrijft ook volledig herstel bij patiënten die gebruik maken van schildklierhormoonsupplementen (Myhill, 2018).
Dit wekte mijn interesse om de relatie tussen het immuunsysteem en de werking van schildklierhormonen op cellulair niveau te begrijpen. Ik was in het bijzonder geïnteresseerd om te leren of de verhouding tussen het immuunsysteem en de schildklierhormonen een feedbackloop tot stand kon brengen, waardoor een patiënt “vastloopt” in een ME/cvs-achtige ziektetoestand.
Ik ontdekte dat de samenhang tussen inflammatie en de werking van de schildklierhormonen al tientallen jaren wordt bestudeerd en nog steeds wordt bestudeerd in de context van een aandoening die “niet-thyroïdaal ziektesyndroom” (NTIS) wordt genoemd – ook wel “euthyroïd ziektesyndroom” of “laag T3-syndroom” genoemd – wat vaak optreedt bij ernstige letsels, levensbedreigende aandoeningen en na chirurgische ingrepen. Bovendien leerde ik dat enkele van de recentere studies over NTIS “vicieuze cirkels” beschrijven die worden veroorzaakt door cytokines, oxidatieve stress en schildklierhormoonactiviteit, waarbij een aantal patiënten ziek blijven in een vorm van “langdurige” of “chronische” NTIS (Mancini et al., 2016; Chatzitomaris et al., 2017).
Daarnaast zijn er tot mijn verbazing vele fysiologische overeenkomsten tussen ME/cvs en NTIS, waaronder: neerwaartse regulering van het metabolisme, verminderde mitochondriale activiteit, oxidatieve stress, kenmerkende cytokinehandtekeningen, gewijzigde immuuncelactiviteit, ontregeling van de bijnierhormonen, enz. (zie tabel 1 aan het einde van de blogpost).
In deze post zal ik betogen dat de conclusies van vijf decennia NTIS-onderzoek waarschijnlijk belangrijke inzichten verschaffen in de mechanismen die ten grondslag liggen aan ME/cvs.
In de eerste plaats geef ik een overzicht van enkele mechanismen die in de literatuur over NTIS beschreven worden, in het bijzonder de “vicieuze cirkel” die door sommige onderzoekers beschreven wordt (deel 1). Ten tweede vat ik enkele van de belangrijkste implicaties samen van verhoogde cytokines en oxidatieve stress, en verminderde schildklierhormoonactiviteit – en de overeenkomsten met ME/cvs (deel 2). Tot besluit presenteer ik kort, met het oog op hun mogelijke toepassing op ME/cvs, de lopende discussies over de behandeling van NTIS (deel 3).
Hoewel deze blogpost zich richt op de mechanismen die samenhangen met veranderingen in de activiteit van schildklierhormoon, is het van belang op te merken dat andere endocriene systemen ook gewijzigd worden bij zwaar letsel en levensbedreigende ziekten, meer bepaald groeihormoon en de HPA-as (van den Berghe, 2016). Onderzoek op het gebied van de spoedeisende geneeskunde naar deze endocriene systemen en andere aspecten van levensbedreigende ziekten (zie bijlage) kan ook relevant zijn voor het begrijpen van de mechanismen van ME/cvs, maar valt buiten het kader van deze blogpost.
Deel 1: Mechanismen bij NTIS
Vanaf het begin van de jaren zeventig constateerden artsen die op spoeddiensten werkten, dat patiënten met een breed scala aan levensbedreigende aandoeningen – uithongering, ernstige brandwonden, hoofdletsels, sepsis, hartchirurgie, nierfalen, enz. – lage plasmaconcentraties hadden van de actieve vorm van schildklierhormonen (T3) en hoge plasmaconcentraties van inactieve schildklierhormonen (omgekeerde T3; rT3) (Warner en Beckett. 2010).
In de loop van de jaren werd duidelijk dat dit patroon van veranderde concentraties van schildklierhormoon kan optreden in reactie op vrijwel elke ernstige vorm van infectie, zwaar letsel, ziekte of chirurgische ingreep (De Groot, 1999; Wajner et al., 2012). Artsen gaven deze aandoening de naam “niet-thyroïdaal ziektesyndroom” (NTIS), ook wel “euthyroïd ziektesyndroom” of “laag T3-syndroom” genoemd.
In het besef dat schildklierhormonen de snelheid van ons metabolisme reguleren, werd NTIS in eerste instantie beschreven als een toestand van “beschermende” neerwaartse regulering van het metabolisme in tijden van bedreiging, d.w.z. een vorm van “hypometabolisme” om energie te sparen (Carter et al. 1974).
De aanvankelijke veronderstelling dat NTIS een “beschermende” neerwaartse bijstelling van de stofwisseling is, wordt echter steeds meer in vraag gesteld door NTIS-onderzoekers – in het bijzonder in het geval van chronische of langdurige in plaats van acute of voorbijgaande gevallen van NTIS (Boelen, 2011; van den Berghe, 2016).
Naarmate de mechanismen die betrokken waren bij NTIS duidelijker werden, begonnen onderzoekers steeds meer te suggereren dat chronische NTIS een “onaangepast proces” was. Los van de initiële ziekte of aanleiding leken sommige patiënten vast komen te zitten in een chronische, hypometabole toestand, waaruit ze moeilijk konden ontsnappen (Plikat et al., 2007).
Op basis van bijna vijf decennia aan NTIS- en aanverwante studies, hebben onderzoekers een model voorgesteld dat beschrijft hoe de vicieuze cirkel, die sommige mensen vasthoudt in een langdurige of chronische toestand van NTIS, tot stand komt. Dit model suggereert dat deze hypometabole toestand in stand wordt gehouden door de onderlinge relaties tussen ontstekingscytokines, verminderde schildklierhormoonactiviteit en oxidatieve stress (Mancini et al., 2016; Chatzitomaris et al., 2017).
Figuur 1: Vereenvoudigd model van NTIS, gebaseerd op het artikel van Mancini, et al. 2016 (zie het artikel voor het meer complexe model).
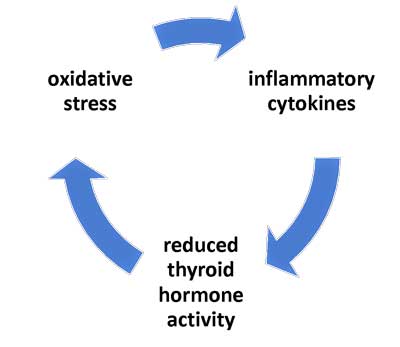
Hoewel men vroeger dacht dat het een beschermend mechanisme was dat wordt veroorzaakt door ernstige ziekte, gaat men er intussen van uit dat een langdurige vorm van NTIS een onaangepaste reactie is, die plaatsvindt wanneer cytokines en oxidatieve stress de schildklierhormoonactiviteit beïnvloeden.
Dit vereenvoudigde model behandelt niet alle aspecten van NTIS, noch omvat het de bijbehorende veranderingen in andere endocriene systemen tijdens levensbedreigende ziekte (zoals het bijnierhormoonsysteem), maar het is wel een goede kennismaking met het gros van de literatuur over NTIS.
De belangrijkste elementen van deze voorgestelde “vicieuze cirkel” bij langdurige NTIS omvatten de volgende mechanismen:
- cytokines onderdrukken de activiteit van schildklierhormoon;
- lage activiteit van schildklierhormoon draagt bij tot oxidatieve stress;
- oxidatieve stress stimuleert de productie van pro-inflammatoire cytokines – en maakt zo de cirkel rond.
Ik zal deze mechanismen in detail uitleggen in de volgende drie subsecties.
Mechanisme #1: Cytokines onderdrukken activiteit van schildklierhormoon
Cytokines : Cytokines zijn proteïnen met een laag moleculair gewicht die de aard, intensiteit en duur van de immuunrespons reguleren en die een belangrijke rol spelen bij auto-immuun- en inflammatoire ziekten. Cytokines zijn zeer veelzijdig en kunnen op verschillende manieren werken: autocrien (aantasting van eenzelfde cel), paracrien (aantasting van cellen in de buurt) of endocrien (aantasting van cellen ver weg) en kunnen verschillende cellen op verschillende manieren beïnvloeden. Door een zogenaamd cascade-effect stimuleren cytokines vaak de productie van andere cytokines. Er bestaan meer dan 50 cytokines en chemokines.
In een poging om de mechanismen achter NTIS te begrijpen, volgden de wetenschappers een belangrijke aanwijzing: het feit dat veranderingen in plasmaconcentraties van geactiveerde (T3) en geïnactiveerde (rT3) schildklierhormonen ook samenhangen met wijzigingen in cytokineniveaus (Boelen et al., 1993; Davies et al., 1996; Maura Neto et al., 2016).
In de afgelopen decennia hebben onderzoekers steeds meer duidelijkheid gekregen over de manieren waarop cytokines de activiteit van schildklierhormonen onderdrukken. Deze kunnen worden onderverdeeld in submechanismen op (i) “centraal niveau” (d.w.z. “boven de nek”) en (ii) “perifeer niveau” (d.w.z. “onder de nek.”).
Ik zal een kort overzicht geven van deze submechanismen in de paragrafen hieronder. Twee belangrijke kernpunten van dit proces zijn echter de volgende:
Ten eerste zorgen deze submechanismen voorweefselspecifieke neerwaartse bijstelling van het metabolisme. Interessant is dat het metabolisme van de verschillende weefsels (lever, nieren, hersenen, hart, vetweefsel en andere weefsels) met verschillende snelheden wordt verlaagd, wellicht in de volgorde van belang van de organen om te overleven.
Ten tweede, door alleen maar te kijken naar de concentraties van geactiveerd en geïnactiveerd schildklierhormoon in het plasma (zoals meestal het geval is in klinische omgevingen), zien we alleen het “topje van de ijsberg” van de veranderingen in de activiteit van schildklierhormonen die zich voordoen op het niveau van de weefsels (Ruiz – Nunez et al., 2018; Donzelli et al., 2016). In de praktijk worden de veranderingen van het schildklierhormoon op weefselniveau overigens vaak gemakkelijk over het hoofd gezien (Dietrich et al., 2016).
(a) “Centraal niveau”: hoe cytokines de gehele productie van schildklierhormonen onderdrukken
Bij chronische NTIS kunnen cytokines die focussen op de hypothalamus (in het midden van de hersenen), de hypofyse (aan de voorkant van de hersenen) en de schildklieren (in de nek) leiden tot een vermindering van de algehele productie van schildklierhormonen.
Onder normale omstandigheden werkt een feedbacksysteem van schildklierhormonen als een thermostaat om een stabiele concentratie van schildklierhormonen in het plasma te behouden volgens een dagelijks patroon (Fisher, 1996). Samengevat: wanneer de concentratie van geactiveerde schildklierhormonen in het plasma onder een bepaalde drempelwaarde zakt, produceert de hypothalamus thyrotropine-afscheidende hormonen (TRH) om de hypofyse aan te zetten tot de productie van schildklierstimulerende hormonen (TSH), wat op zijn beurt weer een signaal geeft aan de schildklier om meer schildklierhormoon te produceren (TH).
Figuur 2: De cascade van de productie van schildklierhormoon (TH)

In het geval van chronische NTIS wordt de productie van TRH door de hypothalamus echter afgeremd door cytokines (b.v. IL-12 en IL-18), in combinatie met andere signalerende factoren (waaronder leptine, glucocorticoïden, enz.) (Boelen e.a. 2004; Chatzitomaris e.a., 2017).
Er wordt aangenomen dat dit gebeurt door een “opwaartse regulering” van de dejodase-enzymen D1 en D2, die de grotendeels inactieve vorm van het schildklierhormoon (T4) omzetten in de actieve vorm (T3) in de hypothalamus. De lokaal verhoogde T3-niveaus geven de hypothalamus dan de “indruk” dat de actieve hormoonspiegels in orde zijn (Joseph-Bravo et al., 2015). Het is net alsof de lucht rond de thermostaat wordt opgewarmd, waardoor het lijkt alsof het huis warm genoeg is.
Daardoor moeten bij chronische NTIS de schildklierhormoonspiegels in het plasma veel meer dalen dan normaal, opdat de hypothalamus het proces in gang zou zetten dat (via TRH en TSH) leidt tot de productie van meer schildklierhormoon in de schildklier. Onderzoekers noemen dit een wijziging in het “instelpunt” van het feedbackmechanisme tussen de plasmaconcentratie van T3 en de afgifte van TRH (Chatzitomaris et al., 2017). (Noot: Dit fenomeen verklaart ook waarom de TSH-niveaus normaal kunnen lijken in bloedonderzoeken, zelfs als de niveaus van schildklierhormoon in het plasma laag zijn.)
Zonder in detail te treden, verminderen cytokines (bijv. IL-1b en TNF-α), via een proces dat “TSH-onderdrukking” wordt genoemd, bovendien ook de afgifte van TSH door de hypofyse (Harel et al., 1995; Wassen et al. 1996). Ten slotte hebben cytokines (bv. IL-1), door het verminderen van de opname van jodium en de uitscheiding van schildklierhormoon, ook een invloed op de activiteit van de schildklier zelf (Bartelena, 1998; De Groot 1999).
Het resultaat van deze “centrale” mechanismen – namelijk de wijziging van het “instelpunt” voor de TRH-productie, de “TSH-onderdrukking” en/of de blokkering van de schildklier – is een algemene daling van de schildklierhormonen in het plasma, wat leidt tot een veralgemeend hypometabolisme.
Er dient opgemerkt te worden dat deze “centrale” mechanismen een rol spelen bij langdurige of chronische NTIS. Tijdens de acute en vroege stadia van NTIS, zorgen “perifere” mechanismen ervoor dat de stofwisseling snel neerwaarts wordt bijgesteld om te helpen bij het behoud van de energiereserves (Wajner et al. 2012; van den Berghe, 2014). Ik zal deze mechanismen hierna toelichten.
(b) “perifeer niveau”: hoe cytokines de activiteit van schildklierhormoon onderdrukken op een manier specifiek per weefsel
In acute en vroege stadia van NTIS leiden mechanismen waarbij cytokines betrokken zijn, tot een snelle afname van de activiteit van schildklierhormoon op een manier die specifiek is per weefsel.
Onder normale omstandigheden moeten, eens de schildklierhormonen door de schildklier in het plasma afgescheiden zijn, verdere stappen doorlopen worden voordat ze het metabolisme van het betrokken weefsel kunnen beïnvloeden. Eenvoudig gezegd:
- schildklierhormonen worden eerst “gebonden” aan schildklierhormoonbinders en door het lichaam getransporteerd;
- cellulaire transporteurs “verplaatsen” vervolgens de schildklierhormonen naar de cellen;
- binnen de cellen “converteren” dejodasen de schildklierhormonen in een actieve of inactieve vorm;
- wanneer het actieve schildklierhormoon vervolgens wordt “opgevangen” door celkernreceptoren, starten de doelcellen de gentranscriptie. (In het andere geval, als een inactieve vorm van schildklierhormoon (rT3) zich op de celkernreceptoren vastzet, wordt de gentranscriptie gestopt).
(Opmerking: schildklierhormonen kunnen ook interageren met andere elementen in de cellen om “niet-genomische” resultaten in gang te zetten).
Een wijziging in een van deze stappen kan leiden tot grote “tijdstip- en weefselspecifieke” aanpassingen in het celmetabolisme – zelfs zonder of met slechts geringe veranderingen in de plasmaconcentraties van schildklierhormonen (Gereben e.a., 2008; Mendoza e.a., 2017; Cicatiello e.a., 2018).
Figuur 3: Het traject van schildklierhormonen naar het betrokken weefsel

NTIS-onderzoekers hebben aangetoond dat cytokines (met name IL-1β, IL-6, TNF-⍺) op elk van deze stappen een impact kunnen hebben (zie de review door Warner and Beckett, 2010; Wajner et al., 2012).
Wijzigingen veroorzaakt door cytokines op het traject van de schildklierhormonen zijn onder meer:
- veranderingen in de hoeveelheid en de affiniteit van schildklierhormoonbinders in het bloed (Bartelena et al., 1992; Bartelena et al., 1998; Afandi et al., 2000);
- wijzigingen in de expressie van de transporteurs die het schildklierhormoon naar de cellen brengen (Mebis et al., 2009);
- de neerwaartse en opwaartse regulering van dejodasen die schildklierhormonen omzetten in respectievelijk hun actieve en inactieve vorm (Bartalena et al., 1998; Huang et al., 2005);
- de variatie in de hoeveelheid en het type (nl. “isovormen”) van de aanwezige schildklierhormoonreceptoren in de cel (Kwakkel et al., 2007; Rodriguez-Perez et al., 2008; Lado-Abeal et al., 2010).
De onderlinge volgorde en het belang van deze verschillende “perifere” mechanismen in het onderdrukken van de activiteit van schildklierhormoon in de verschillende fasen van NTIS en bij de verschillende weefsels, zijn het onderwerp van de meeste NTIS-publicaties (zie de recensies van Warner and Beckett, 2010; Wajner et al., 2012; en Chatzitomaris et al., 2017). (Noot: er zijn ook bijkomende mechanismen voorgesteld; zie bijlage).
De mechanismen die de meeste aandacht gekregen hebben, zijn het effect van cytokines op de neerwaartse regulering van de dejodasen, die schildklierhormonen omzetten in de actieve vorm T3, en de opwaartse regulering van de enzymen die schildklierhormonen omzetten in de inactieve vorm “reverse T3” (rT3).
Ondanks de verschillen die gevonden zijn tussen de soorten weefsel en tussen acute en langdurige NTIS (Mebis et al., 2007; Boelen et al., 2017; Fontes et al., 2017), leiden veranderingen in de activiteit van de dejodasen tijdens NTIS over het algemeen tot een afname van de actieve vorm van schildklierhormoon (T3) en een toename van de inactieve vorm (rT3) in perifere weefsels. Dit verklaart de tweede naam voor het syndroom: “laag T3-syndroom”.
Samengevat: de verschillende “centrale” en “perifere” submechanismen die door cytokines worden teweeggebracht of in stand gehouden tijdens langdurige NTIS, leiden tot een algemene en weefselspecifieke afname van de activiteit van schildklierhormonen – met andere woorden: hypometabolisme. Bovendien zijn de waargenomen veranderingen in de plasmaconcentraties van schildklierhormonen slechts een fractie van de grotendeels onzichtbare veranderingen in de activiteit van schildklierhormonen op het niveau van de weefsels (d.w.z. “het topje van de ijsberg”).
zie ook: https://www.me-gids.net/module-ME_CVS_docs-viewpub-tid-1-pid-2122.html
Mechanisme #2: verminderde schildklierhormoonactiviteit draagt bij tot oxidatieve stress
Oxidatieve stress is de wanverhouding tussen de productie van pro-oxidante stoffen en de antioxidante afweer. Met andere woorden, oxidatieve stress ontstaat wanneer er niet genoeg antioxidanten zijn om de pro-oxidanten in het lichaam te neutraliseren. De belangrijkste pro-oxidanten zijn de reactieve zuurstofverbindingen (reactive oxygen species of ROS) en reactieve stikstofverbindingen (reactive nitrogen species of RNS). ROS en RNS worden gevormd als natuurlijke nevenproducten van het normale metabolisme van respectievelijk zuurstof (bijv. mitochondriale ademhalingsketen) en enzymactiviteit. Enzymen zoals superoxide dismutase (SOD), katalase (CAT) en glutathionperoxidase (GPx), evenals transitiemetaalbindende eiwitten zoals transferrine, ferritine en ceruloplasmine, verhinderen de aanmaak van pro-oxidanten of inactiveren deze snel. Bronnen: Mancini et al., 2016, en Wikipedia.
Zoals hierboven beschreven, hebben onderzoekers aangetoond dat via een aantal mechanismen de activiteit van schildklierhormoon tijdens NTIS door de tussenkomst van cytokines wordt onderdrukt. Dit brengt ons bij het tweede sleutelelement van de “vicieuze cirkel” bij chronische NTIS: een lage activiteit van schildklierhormoon draagt bij tot oxidatieve (en nitrosatieve) stress.
Zowel hypothyreoïdie als hyperthyreoïdie worden al lang in verband gebracht met oxidatieve stress (Canon-Europa et al., 2012). In het geval van hypothyreoïdie is het belangrijkste mechanisme het feit dat de cellen niet in staat zijn voldoende antioxidanten te maken om een gezond oxidatief evenwicht te bewaren. (In het geval van hyperthyreoïdie is het mechanisme de productie van te veel pro-oxidanten.)
Hetzelfde mechanisme dat bij hypothyreoïdie aanwezig is, is ook van toepassing bij NTIS. Concreet leidt de verlaagde activiteit van schildklierhormoon tot een verminderde functie van twee eiwitten (“ontkoppelingseiwit 2 en 3”) met antioxidante eigenschappen (Bianco et al., 1988). Bovendien veranderen lage niveaus van schildklierhormoon in de cellen de vetconcentratie van de celmembranen, die onder normale omstandigheden het oxidatieve evenwicht van de cellen bewaart. Ten slotte worden, als gevolg van de lage schildklierhormoonactiviteit, de door oxidatieve stress beschadigde mitochondriën niet opgeruimd (geciteerd in Mancini et al., 2016). Kortom, wanneer schildklierhormonen minder actief zijn, neemt de intracellulaire oxidatieve stress toe.
Oxidatieve stress remt op zijn beurt de werking af van schildklierhormoon door de strijd om glutathion (GSH) door zowel antioxidantenzymen als de hierboven vermelde dejodasen (Wajner et al., 2012). Wetenschappers menen dat oxidatieve stress “het glutathion uitput” dat nodig is voor de omzetting van T4 in T3, wat leidt tot lagere concentraties van actieve schildklierhormonen.
Op dezelfde manier beweren NTIS-onderzoekers dat de strijd om en de daaruit voortvloeiende uitputting van het sporenelement selenium – een bestanddeel van zowel de dejodasen als de antioxidantenenzymen (Wajner e.a., 2015) – het verband tussen verhoogde oxidatieve stress en een lage activiteit van schildklierhormonen kan versterken.
Kortom, in het geval van een lage activiteit van het schildklierhormoon, is het lichaam niet in staat om voldoende antioxidanten aan te maken om de pro-oxidanten te neutraliseren. Dit leidt tot verhoogde oxidatieve stress, wat de activiteit van de schildklierhormonen nog verder onderdrukt door de strijd om glutathion en selenium in een zichzelf in stand houdende cyclus (d.w.z. een kleinere “vicieuze cirkel” is aanwezig in de grotere cyclus).
Mechanisme #3: Oxidatieve stress stimuleert pro-inflammatoire cytokines
Het laatste mechanisme dat de “vicieuze cirkel” bij chronische NTIS rond maakt, is het verband tussen oxidatieve stress en ontsteking.
Oxidatieve stress stimuleert de productie van inflammatoire cytokines, met name leptine, resistine, TNF-α, en IL-6 (Chatterjee, 2016).
De inflammatoire cytokines (in het bijzonder IL-6) verhogen op hun beurt de oxidatieve stress verder door de productie van superoxide-radicalen te activeren (Valko et al., 2007; Wajner et al., 2012).
Samengevat leidt oxidatieve stress tot het vrijgeven van extra inflammatoire cytokines die de activiteit van schildklierhormoon verminderen, wat leidt tot meer oxidatieve stress. Er is dus een tendens van oxidatieve stress en pro-inflammatoire cytokines om elkaar te bestendigen (d.w.z. om weer een kleinere “vicieuze cirkel” te vormen binnen de grotere cirkel).
Deel 2: Implicaties van NTIS en overeenkomsten met ME/cvs
In deel 1 heb ik een overzicht gegeven van de belangrijkste mechanismen van de “vicieuze cirkel” die aan de basis ligt van chronische NTIS na een zwaar letsel en levensbedreigende ziekten, zoals beschreven door NTIS-onderzoekers:
- cytokines onderdrukken de activiteit van schildklierhormoon;
- lage activiteit van schildklierhormoon verhoogt de oxidatieve stress;
- verhoogde oxidatieve stress stimuleert de productie van pro-inflammatoire cytokines …. wat de “vicieuze cirkel” bestendigt.
Bovendien geeft het onderzoek aan dat er ook pijlen zijn die de “vicieuze cirkel” doorkruisen. Er zijn onderlinge verbanden tussen de toestand van schildklierhormoon en oxidatieve stress, tussen oxidatieve stress en ontsteking, en tussen oxidatieve stress en de activiteit van schildklierhormoon. Deze kleinere “vicieuze cirkels” binnen de elementen van de grotere “vicieuze cirkel” bij chronische NTIS maken het kennelijk nog moeilijker voor patiënten om uit de valstrik te ontsnappen.
In de volgende paragrafen zal ik de implicatie van deze mechanismen beschrijven en de overeenkomsten met ME/cvs belichten, om te betogen dat het onderzoek naar NTIS ons vermoedelijk informatie kan opleveren om de mechanismen die aan de basis liggen van ME/cvs, beter te begrijpen.
Implicaties van oxidatieve stress
De implicaties van chronische oxidatieve stress in het lichaam zijn uitvoerig beschreven. Oxidatieve stress veroorzaakt celbeschadiging en verstoort de normale transcriptie- en signaalmechanismen van cellen (Mancini et al, 2016).
Talrijke studies hebben een verhoogde oxidatieve stress bij ME/cvs aangetoond. Oxidatieve stress is geïdentificeerd als een factor in de metabole disfunctie bij ME/cvs (Morris en Maes, 2014; Armstrong et al., 2015). Er is inderdaad een model voorgesteld door Prof. Martin Pall dat een “vicieuze cirkel” beschrijft waarbij oxidatieve/nitrosatieve stress en cytokines bij ME/cvs betrokken zijn (vgl. de “NO/ONOOO-cyclus”, 2010). Onderzoekers suggereren ook dat hoge lactaat-/lage glutathionniveaus die in de hersenen van mensen met ME/cvs gevonden worden, waarschijnlijk het gevolg zijn van soortgelijke mechanismen die oxidatieve stress met zich meebrengen (Shungu et al., 2012).
Implicaties van weefselspecifieke verminderde activiteit van schildklierhormoon
Een van de implicaties van langdurige verminderde schildklierhormoonactiviteit bij NTIS is natuurlijk een neerwaartse regulering van het metabolisme. Metabole studies tonen een soortgelijke neerwaartse regulering aan bij ME/cvs (Naviaux et al., 2016). Bovendien is een verminderde mitochondriale activiteit gesuggereerd bij NTIS (Warner and Beckett, 2010) en geconstateerd bij ME/cvs (Myhill et al., 2009; Esfandyarpour et al., 2019).
Uiteraard erkennen veel ME/cvs-artsen nu dat verminderde activiteit van schildklierhormoon een rol speelt bij ME/cvs (zie mijn vorige blogpost). Ruiz-Núñez et al. (2018) vonden dat CVS-patiënten significant lagere niveaus van actief schildklierhormoon (T3) en een hogere verhouding van inactieve ten opzichte van actieve schildklierhormonen (rT3:T3) hadden in vergelijking met de controlegroep.
Bovendien impliceert een weefselspecifieke verlaging van de activiteit van het schildklierhormoon dat sommige organen beter zullen werken dan andere. Experimenten bij ratten hebben aangetoond dat verlaagde niveaus van schildklierhormoon in een bepaalde volgorde voorkomen: ze manifesteren zich (van eerst naar laatst) in de lever, de nieren, de hersenen, het hart en het vetweefsel (Donzelli et al., 2016). Sommige ME/cvs-artsen hebben aangevoerd dat deze weefselspecifieke aanpassingen kunnen helpen de uiteenlopende en veranderende symptomen bij ME/cvs en fibromyalgie te verklaren (Lowe, 2000; Lowe en Yellin, 2008; Holtorf, 2014a en Holtorf 2014b).
De aanhoudende neerwaartse regulering van de activiteit van schildklierhormoon heeft zeker gevolgen voor het immuunsysteem. Auteurs beschrijven de diepgaande effecten van circulerende spiegels van schildklierhormoon op de activiteit van monocyten, lymfocyten, macrofagen, neutrofielen, dendritische cellen en naturalkillercellen (Balaz et al., 1980; Pillay, 1998; Klecha et al., 2005; Klein, 2006; Hodkinson, 2009; Straub et al., 2010; Jara et al., 2017; Bilal et al., 2017; Van der Spek et al., 2018). Met name lijken verlaagde schildklierniveaus de activiteit van naturalkillercellen te onderdrukken (DeVito et al., 2011) – een karakteristieke bevinding bij ME/cvs (Klimas et al., 1990).
Implicaties van gewijzigde cytokineniveaus en onderdrukking van endocriene assen
De veranderingen in cytokines die bij NTIS gevonden zijn – met name de verhoogde markers van ontstekingen – hebben waarschijnlijk veel bijkomende implicaties die nog niet volledig begrepen zijn (Van der Spek et al., 2017). Ook hier kunnen parallellen worden getrokken tussen NTIS en ME/cvs: bij ME/cvs (Montoya et al., 2016) en fibromyalgie (Hernandez et al., 2010) zijn karakteristieke cytokinehandtekeningen gevonden.
Ten slotte kunnen cytokines schuld hebben aan de “centrale” onderdrukking (in de hypothalamus of hypofyse) van groeihormoon en de hormonen van de bijnieras bij langdurige levensbedreigende ziekte (van den Berghen, 2016) – naast de onderdrukking van de schildklierhormoonas (beschreven in deze blogpost). Het is aangetoond dat bij ME/cvs adrenocorticale hormoonassen worden onderdrukt (zie review door Tomas et al., 2013). Verschillende ME/cvs-artsen stellen inderdaad dat de centrale onderdrukking van endocriene hormoonassen een essentieel mechanisme is dat de basis vormt voor ME/cvs (Teitelbaum, 2007; Holtorf, 2008; Purser, 2010) – misschien ligt het wel aan de basis van zowel ME/cvs als van aanhoudende levensbedreigende ziektes?
Deel 3: Nieuwe behandelingen voor NTIS
Op basis van de groeiende erkenning van chronische NTIS als een “onaangepast proces” na een zwaar letsel of levensbedreigende ziekte, zijn onderzoekers op zoek gegaan naar oplossingen die zich toespitsen op de verschillende elementen van de “vicieuze cirkel” die beschreven wordt in deel 1: een lage actieve status van het schildklierhormoon, oxidatieve stress en ontstekingen (zie overzicht in Fliers et al., 2015).
Suppletie van schildklierhormoon
Gezien de verminderde activiteit van schildklierhormoon bij NTIS, begonnen clinici al in de jaren tachtig van de vorige eeuw te suggereren dat schildklierhormoonsuppletie bij levensbedreigend zieke NTIS-patiënten hun overlevingskansen kon doen toenemen (Carter et al., 1977; Brent et al., 1986 en DeGroot, 1999). Over deze aanpak wordt vandaag nog steeds gediscussieerd (Davis, 2008; Kaptein et al., 2010; De Groot, 2015; De Neto et al., 2016; Breitzig et al., 2018).
De resultaten met schildkliersupplementen zijn wisselend (Farwell, 2008), maar meestal gunstig (zie overzicht in Fliers et al., 2015). Interessant is dat er naar verluidt positieve resultaten zijn behaald met schildklierhormoonsupplementen bij NTIS-patiënten die ziek geworden waren na blootstelling aan schimmel (Somppi, 2017).
Gezien de verminderde omzetting van T4 naar T3 bij NTIS, stellen sommige onderzoekers ook een T3-suppletie voor (in plaats van een T4-suppletie) (Biondi, 2014). Bovendien hebben tests op konijnen aangetoond dat de doses voor de suppletie van schildklierhormoon zeer hoog moeten zijn om resultaten te bekomen (Debavaye, 2008). Deze suggesties over de aard en de hoeveelheid van de suppletie van schildklierhormoon bij NTIS sluiten aan bij de argumenten van sommige artsen over T3-suppletie voor ME/cvs.
Veel studies concluderen eenvoudigweg dat er meer onderzoek nodig is naar de effecten van het gebruik van schildklierhormoonsupplementen op de thyroïdspiegels van de weefsels, enz. bij NTIS:
“Het is inderdaad waarschijnlijk dat een volledig begrip van de pathofysiologische mechanismen op weefselniveau zal helpen om de patiënten te identificeren die baat zouden hebben bij een substitutietherapie”. (Mancini et al., 2016).
Stimulering van de hypothalamus en de hypofyse
Van den Berghe et al. (2002, 2014, 2016) bereikten metabole verbeteringen dankzij infusies van peptide dat groeihormoon vrijgeeft en thyreotropinevrijmakend hormoon (TRH) bij patiënten met langdurige levensbedreigende ziekten. M.a.w., ze zijn erin geslaagd om de “vicieuze cirkel” bij langdurige NTIS te doorbreken door de hypothalamus en hypofyse te stimuleren om de concentraties van schildklierhormoon te herstellen (zie “centrale mechanismen” in hoofdstuk 1 hierboven).
Cruciaal is dat ze op deze manier niet alleen problemen hebben aangepakt bij de hypothalamus-hypofyse-schildklieras, maar ook bij andere endocriene assen die door de hypothalamus worden aangestuurd – met name de hypothalamus-hypofyse-groeihormoonas en de hypothalamus-hypofyse-bijnieras – die niet worden behandeld in dit blogartikel, maar die ook worden beïnvloed bij levensbedreigende ziekte en zwaar letsel (en die samenwerken met de schildklieras).
Suppletie met antioxidanten
In één geval hebben onderzoekers geconstateerd dat de behandeling van patiënten die een acuut hartinfarct hadden, met nacetyl-cysteïne (NAC) – een voorloper van het antioxidant GSH – de afname van de serum T3-niveaus virtueel kon opheffen en de gebruikelijke stijging van het serum rT3-niveau kon voorkomen (Vidart et al., 2014). M.a.w., ze hebben blijkbaar de “vicieuze cirkel” doorbroken door het oxidatieve evenwicht te herstellen via de toediening van antioxidanten. (Herinner je dat tijdens oxidatieve stress, de strijd voor GSH door zowel de antioxidantenzymen als de dejodasen leidt tot een verstoorde omzetting van schildklierhormonen en een toename van pro-inflammatoire cytokines).
Cytokineblockers
Onderzoekers hebben geprobeerd de vicieuze cirkel bij NTIS te doorbreken door de IL-1 cytokinereceptoren (door middel van een receptorantagonist) te blokkeren, maar dit had geen effect op de daling van T4, vrij T4, T3, en TSH of de stijging van de rT3, veroorzaakt door endotoxine (van der Poll, 1995). Dit is niet verwonderlijk, aangezien “cytokines in een zeer complex netwerk met elkaar verbonden zijn en de expressie van andere cytokines, in positieve of negatieve zin, beïnvloeden; het is dan ook moeilijk in te schatten hoe deze wisselwerking en de cascade van gebeurtenissen kan worden doorbroken” (Bartelena, 1998). (Vergeet niet dat IL-1 cytokines betrokken zijn bij zowel de centrale, als de perifere mechanismen die de activiteit van schildklierhormoon verminderen).
Moduleren van het immuunsysteem
Een interessante hypothese stelt dat “het immuunsysteem – niet het endocriene systeem – het proces van schildklierhormoonproductie opnieuw op gang brengt” tijdens het genezingsproces van NTIS (Klein, 2006). Deze hypothese wordt verder ondersteund door de verrassende bevinding dat immuuncellen in staat zijn om zelf TSH, T4 en T3 te produceren (Bilal et al, 2017).
Klein schrijft: “Het immuunsysteem, dat inderdaad in staat is om TSH te produceren, zou uitermate geschikt zijn om het optimale moment te bepalen om de herstelfase van schildklierhormoon te starten. Een cruciale factor hierbij zou de inherente capaciteit van het immuunsysteem zijn om voortdurend de status van de infectieuze aandoening te beoordelen, en zo te bepalen of het al dan niet veilig is voor de gastheer om naar een normale metabole activiteit terug te keren “.
Volgens deze logica – en vanuit het besef dat schildklierhormonen een regulerend effect hebben op het immuunsysteem – hebben sommigen voorgesteld om de immuunfuncties te moduleren via klinische manipulatie van de niveaus van schildklierhormonen (DeVito et al., 2011). Suppletie met schildklierhormonen kan dus op minstens twee manieren dienen om de “vicieuze cirkel” te doorbreken: direct door het verhogen van de activiteit van schildklierhormoon, en indirect door het moduleren van het immuunsysteem.
Kortom, de overlap in mogelijke behandeling van ME/cvs en NTIS onderstreept hoe belangrijk het is dat de resultaten van NTIS-onderzoek ook in het kader van ME/cvs in overweging worden genomen.
Besluit
Gezien de overeenkomsten tussen de profielen van ME/cvs en chronische NTIS na zwaar letsel en levensbedreigende ziekte (zie tabel 1 hieronder), kunnen de bevindingen uit vijf decennia aan NTIS-onderzoek ook relevant zijn voor het begrijpen van de mechanismen achter ME/cvs.
Kenmerkend voor NTIS is de lage activiteit van schildklierhormoon, die bij langdurige of chronische NTIS wordt gestuurd door cytokines en oxidatieve stress door zowel “centrale” als “perifere” mechanismen. De lagere niveaus van schildklierhormoon in het plasma, die onmiddellijk worden waargenomen bij NTIS, weerspiegelen waarschijnlijk slechts het “topje van de ijsberg” van de niveaudalingen van schildklierhormoon, die op weefselniveau bij deze levensbedreigend zieke patiënten worden vastgesteld.
Onderzoek naar chronische NTIS heeft de wederzijdse relaties tussen cytokines, activiteit van schildklierhormoon en oxidatieve stress aan het licht gebracht, wat suggereert dat het zou kunnen dat chronische NTIS-patiënten vast zitten in een “vicieuze cirkel”.
De gevolgen van de weefselspecifieke neerwaartse bijstelling van de schildklierhormoonactiviteit op het lichaam zijn talrijk, met inbegrip van een onderdrukte functie van het immuunsysteem.
NTIS-onderzoekers en clinici die op zoek zijn naar manieren om patiënten uit deze “vicieuze cirkel” te bevrijden, maken gebruik van experimentele behandelingen, die vergelijkbaar zijn met die van sommige ME/cvs-behandelaars. Het gaat om onder andere suppletie met schildklierhormonen, toediening van hormonen die door de hypothalamus worden afgescheiden, suppletie met antioxidanten, en pogingen om het effect van cytokines te verminderen.
Bijkomend onderzoek naar zwaar letsel en levensbedreigende ziekte beschrijft een vergelijkbaar patroon van “centrale” (hypothalamus of hypofyse) onderdrukking van andere endocriene systemen die niet worden behandeld in deze blog (d.w.z. de hypothalamus-hypofyse- groeihormoonas en de hypothalamus-hypofyse-bijnieras). De onderdrukking van endocriene assen op een centraal niveau resoneert met de hypothesen van verschillende ME/cvs-artsen.
Tot slot stel ik dat verdere interacties tussen onderzoekers die werken aan ME/cvs en zwaar letsel en levensbedreigende ziekten wellicht van groot nut zouden zijn voor beide onderzoeksgemeenschappen in de speurtocht naar behandelingen voor zowel NTIS als ME/cvs.
Lees ook over lage T3-waarden bij Health Rising:
Tabel 1: Overeenkomsten tussen NTIS en ME/cvs
De bevindingen van recent onderzoek naar “biomerkers” of “handtekeningen” bij ME/cvs zijn vergelijkbaar met de bevindingen bij NTIS. De lijst van overeenkomsten die in de onderstaande tabel worden belicht, is niet uitputtend, maar kan volstaan om te suggereren dat het onderzoek naar de mechanismen achter chronische NTIS naar alle waarschijnlijkheid relevant is voor het begrijpen van de mechanismen achter ME/cvs.
|
Bevindingen bij ME/cvs |
Details voor ME/cvs |
Gelijkenissen bij NTIS |
|
Gewijzigde activiteit immuuncellen |
Klimas et al. (1990) en vele anderen hebben verminderde functie van naturalkillercellen gevonden bij ME/cvs-patiënten. |
Een langdurig tekort aan schildklierhormoon staat in verband met de aantasting van het cellulaire immuunsysteem (Pillay, 1998; Van der Spek et al., 2017) – met name de verminderde activiteit van naturalkillercellen (DeVito et al., 2011). |
|
Neerwaartse regulering van het metabolisme |
Naviaux et al. (2016) vonden afwijkingen in de metabolieten van ME/cvspatiënten, “in lijn met een hypometabool syndroom.” |
NTIS wordt gekenmerkt door een lage activiteit van schildklierhormonen waardoor een algehele hypo-metabole toestand ontstaat (Warner and Beckett, 2010; Wajner et al., 2012). |
|
Verlaagde werking van de mitochondriën |
Myhill et al. (2009) toonden aan dat ME/cvs-patiënten niet in staat waren om ATP-voorraden aan te vullen, wat toe te schrijven is aan verminderde mitochondriale activiteit. Zie ook Esfandyarpour et al. (2019). |
Een vermindering van de intracellulaire ATP is ook voorgesteld als een mechanisme bij NTIS (Warner and Beckett, 2010). |
|
Specifieke cytokinehandtekening |
Montoya e.a. (2017) vonden dat 17 cytokines positief gecorreleerd waren met de ernst van ME/cvs, waarvan er 13 pro-inflammatoir waren (zie ook Hornig e.a., 2015). Ook bij fibromyalgiepatiënten zijn de circulatieniveaus van proinflammatoire cytokines gewijzigd (Hernandez et al., 2010). |
NTIS wordt al lang geassocieerd met veranderingen in cytokines (Boelen et al., 1993; Bartelena et al., 1998). |
|
Oxidatieve stress |
ME/cvs wordt in verband gebracht met oxidatieve stress (Morris en Maes, 2014; Armstrong et al., 2015). |
Oxidatieve stress is een essentieel mechanisme bij NTIS (zie Wajner et al., 2012; Mancini et. al., 2016 en Chatzitomaris et al., 2017). |
|
Verminderde plasmaspiegels van actief schildklierhormoon; verhoogde niveaus van biologisch inactieve schildklierhormonen |
Ruiz-Núñez’s et al. (2018) vonden dat cvs-patiënten, als een groep, significant lagere niveaus hadden van “Totaal T3” (TT3) (d.w.z. de actieve vorm van schildklierhormonen) en een hogere “rT3 op de totale T3-verhouding” (rT3:TT3) dan de controlegroep – wat betekent dat de verhouding tussen de inactieve en de actieve schildklierhormonen groter is. Ze schrijven: “verlaagd circulerend T3 en de kennelijke verschuiving van T3 naar rT3 kan een weerspiegeling zijn van ernstiger gedaalde T3-niveaus in het weefsel.” |
NTIS is per definitie een vermindering van het gehalte van het actieve schildklierhormoon in het plasma. (Chopra, 1979; Warner en Beckett, 2010). De afname van de T3/rT3-ratio wordt beschouwd als de meest gevoelige parameter voor de diagnose van NTIS (Neto et al., 2016). |
|
Ontregeling van de bijnierhormonen |
Di Giorgio e.a. (2016) hebben vastgesteld dat de hypothalamus-hypofyse-bijnieras bij ME/cvs patiënten ontregeld is (zie ook: Teitelbaum, 1996; Durrant-Peatfield, 2006; Skinner, 2003, Tomas et al., 2013). |
“Langdurige NTIS wordt gekenmerkt door een gelijkmatige onderdrukking van de neuro-endocriene assen, voornamelijk van centrale (hypothalamus) oorsprong, wat bijdraagt tot de lage (of onvoldoende hoge) circulerende niveaus van hormonen” (van den Berghe, 2016). |
|
Diverse triggers |
Chu et al. (2019) vermeldt dat de meest voorkomende voorvallen uit de periode rond het begin van de ziekte die door de proefpersonen werden gemeld, infectie-gerelateerde incidenten waren (64%), stressvolle voorvallen (39%) en blootstelling aan giftige stoffen in het milieu (20%). |
NTIS treedt op als nasleep van vrijwel elke ziekte of chirurgische stress (De Groot, 1999; Wajner et al., 2012). |
Annex: bijkomende mechanismes in NTIS
Naast de “vicieuze cirkel” en de “centrale” en “perifere” mechanismes die in deze post beschreven staan – en waarop de meeste publicaties over NTIS zich focussen – kijken onderzoekers ook naar bijkomende schildklierhormoonactiviteit en aanverwante mechanismes bij NTIS.
Ik lijst er hier enkele op die deels overeenkomen met ME/cvs-onderzoek:
- De centrale onderdrukking (door de hypothalamus) van de hypofyse – groeihormoonas en van de hypofyse – bijnier-cortisolas (van den Berghe, 2016)
- De verdrijving van schildklierhormonen uit hun schildklierhormoonbinders door vetzuren (De Groot, 2015) en door salicylaten (Biondi, 2014);
- De remming van schildkliertransport naar de cellen door niet-veresterde vetzuren en bilirubine (De Groot, 2015);
- De bemiddeling van de activiteiten van dejodasen door glucocorticoïden, oestradiol, groeihormoon (Gereben, 2008) en serotonine (Kharrazian, 2011);
- Nieuwe transcriptiemechanismen van schildklierhormoon (Singh, 2018);
- Variaties in de “niet-genomische” effecten van schildklierhormonen (Incerpi, 2018) – met name op celmembranen (DeVito, 2011);
- Variaties in het afscheiden van geactiveerde schildklierhormonen terug in de bloedbaan door de lever – een belangrijke bron van geactiveerd schildklierhormoon (Volkmar, 2005);
- Variaties in vrijgave van schildklierhormoon door de darm – een belangrijke reserve van schildklierhormonen (Duszka, 2018);
- Veranderingen in de “opruiming” van respectievelijk actieve en geïnactiveerde schildklierhormonen uit het lichaam (Bartalena, 1998);
- De afbraak van schildklierhormonen door sulfatatie, conjugatie en splitsing (Chatzitomaris et al., 2017.);
- De rol van lipopolysaccharide (LPS) – een bacteriële endotoxine uit gramnegatieve bacteriën in de darm – bij modulatie van perifere mechanismen;
- Het omgekeerde effect van schildklierhormonen op het vrijkomen van cytokinen (Volkmar, 2005; Hodkinson 2009; DeVito et al., 2011; Rozing et. al, 2011);
- etc.
Lijst met referenties [in het Engels]
© Health Rising. Vertaling Els, redactie Abby en Zuiderzon, ME-gids.





